ナノSIMSと同位体標識法を用いた植物鉄キレート剤ニコチアニミンの空間分布解析への応用
ナノSIMSと同位体標識法を用いた植物鉄キレート剤ニコチアニミンの空間分布解析への応用
Application of NanoSIMS and isotopic labelling to analyze spatial distribution of the plant iron chelator nicotianamine
Nozoye T, Takeuchi M, Hollmann F, Clemens S,
Journal of Biological Chemistry (2025), doi: https://doi.org/10.1016/j.jbc.2025.110478.
要約
ニコチアナミン(NA)は、植物体および細胞内での鉄(Fe)の輸送と移動を司る鉄キレート剤です。NAは、植物における鉄欠乏シグナル伝達因子として鉄の恒常性維持に関与していると考えられています。本研究では、高分解能二次イオン質量分析法(NanoSIMS)を用いて、植物内の安定同位体標識NAの分布を可視化することで、NAを介した鉄の輸送、移動、および鉄の恒常性維持のメカニズムを解明することを目的としました。安定同位体標識NA(15N-NA)は、酵母におけるNA合成酵素の異種発現により生成され、野生型(WT)トマト植物とNA欠損変異体chloronerva(chln)に供給されました。NanoSIMSの結果、15N-NAのシグナルは、WTとchlnの両方で鉄が蓄積する導管周辺の組織に集中していました。当研究の結果は、NanoSIMSが植物体内でのNA局在化を直接調査する強力なツールであることを示しています。
以下論文の肝の部分だけ訳しました。
ナノSIMS解析により、15N-NAが木部周辺の細胞に蓄積していることが判明し、鉄の局在化と一致する結果でした。15N化合物が茎の基部に供給されたため、木部周辺の細胞における15Nの高蓄積は、15211 N-NAが木部から吸収され、その後周辺の細胞へ輸送された可能性を示唆しています(図2)。根の細胞壁におけるFe濃度は、chlnではWTに比べて極めて低く、細胞質と液胞におけるFe濃度はchlnでWTよりも高かったことが報告されています。NAを適用すると、chlnとWTの間のこれらの差が消失し、NAがアポプラストのFeの溶解と利用に必要であることを示唆しています。X線吸収近辺構造(XANES)も、chlnの葉脈における二価鉄の存在量がWTや葉脈間領域よりも低いことを示し、NAがトマト葉の葉脈における鉄の二価形態の維持に関与している可能性を示唆しています。同様に、鉄の局在は主に根、茎、葉の血管系に観察されました(図3-5)。細胞内では、液胞内の15Nシグナルは細胞質よりも高い傾向にあり、15N-NAが細胞に取り込まれ、その後液胞へ輸送される可能性を示唆しています(図2)。
実際、抗NA抗体を用いた免疫染色により、NAは鉄が十分な条件下および鉄が不足する条件下で細胞質に局在し、
鉄が豊富な条件下では小胞体に移動することが示唆されました。NAが鉄の
スカベンジャーとして機能し、液胞への封じ込めにより細胞を保護する可能性が提唱されました。しかし、15N-NAを含むサンプルと、15Nで培養されたVCの抽出物を含むサンプルの両方で、細胞質と液胞における15Nシグナルが観察されました(図2)。同様に、WTとchlnの両方のサンプルにおいて、15Nの濃度はサンプル間で差がありませんでした。さらに、観察されたシグナルは、未認識のNA代謝物によって生成された可能性もあります。これに対応するため、15Nを同位体トレーサーとして使用するメタボロミクスアプローチが必要となります。複数の組織において複数の条件下でnanoSIMSを適応させることで、NAの鉄輸送における役割を明らかにする可能性があります。
結論として、本研究は、NanoSIMSと同位体標識の組み合わせが、金属キレート剤NAのような分子の細胞内および組織レベルでの移動を特定する大きな可能性を有することを示しました。さらなる改善は、NAの生理学的理解を深めるのに貢献する可能性があります。
図の凡例(図は1,2,3しか示せないが、4,5も訳しておいた)
図1. 酵母抽出物を用いたトレーサー実験。クロロネルバ(chln)の茎は水耕栽培で培養され、トレーサー実験に用いられた(A)。茎は、鉄不含の水耕培養液(陰性対照;NC)、鉄含有(+Fe)およびGFP酵母抽出物(+Fe+GFP)、鉄とGFP-AtNAS2酵母抽出物(14N-NA含有)を含む溶液(+Fe+14N-NA)に浸漬された。(+Fe+14 N-NA)、またはFeとGFP-AtNAS2酵母抽出物(15N-NA含有;+Fe+15NNA)に浸漬した。2日後、茎のFe(B)、Zn(C)、Mn(D)濃度を分析した。水耕栽培で培養された野生型(WT)の茎の金属濃度も測定した。 値は3つの生物学的複製平均を表す。エラーバーは標準偏差を示す。DWは乾燥重量。異なる文字はTukey-Kramer HSD検定(n = 3、P < 0.1)による有意差を示す。
図2. 高解像度二次イオン質量分析(NanoSIMS)画像で示されるトマト植物の葉(野生型;A、C、クロロネルバ;B、D)における15Nの分布。トレーサー実験において、15N-NAを含むGFP-AtNAS2酵母の抽出物(A、B)および15Nを含む培地で培養されたVC酵母の抽出物(C、D)を使用し、15Nの分布を分析した。バー、10 μm。
図3. 野生型(WT;C、E、G、I)とクロロネルバ(chln;D、F、H、J)の葉におけるFeの局在化を、Perlのプルシアンブルー-DAB法で示した。
処理前のWT(A)またはchln(B)の葉の横断面もそれぞれ示されている。大きな血管束(E、F)、 中葉細胞(G、H)、および毛状体(I、J)が拡大表示されている。スケールバー、50 μm(A-D)または20 μm(E-J)。
図4. 野生型(WT;C、E、G、I、K)とクロロネルバ(chln;D、F、H、J、L)の茎におけるFeの局在化を、Perlのプルシアンブルー-DAB法で示した。WT(A)またはchln(B)の処理前の茎の断面もそれぞれ示された。大きな血管束(E, F)、表皮(G, H)、皮層(I, J)、および毛状体(K, L)が拡大表示されている。スケールバー:50 μm(A-D)または20 μm(E-L)。
図5. 野生型(WT;C、E、G、I)とクロロネルバ(chln;D、F、H、J)の根におけるFeの局在化をPerlのプルシアンブルー-DAB法で示した。処理前の根の縦断面(WT:A、chln:B)もそれぞれ示されている。Feの局在化は、縦断面(C、D)と横断面(E、F)で観察された。血管束(G、H)と皮層(I、J)は拡大表示されている。スケールバー:1 mm(A、B)または20 μm(C-J)。
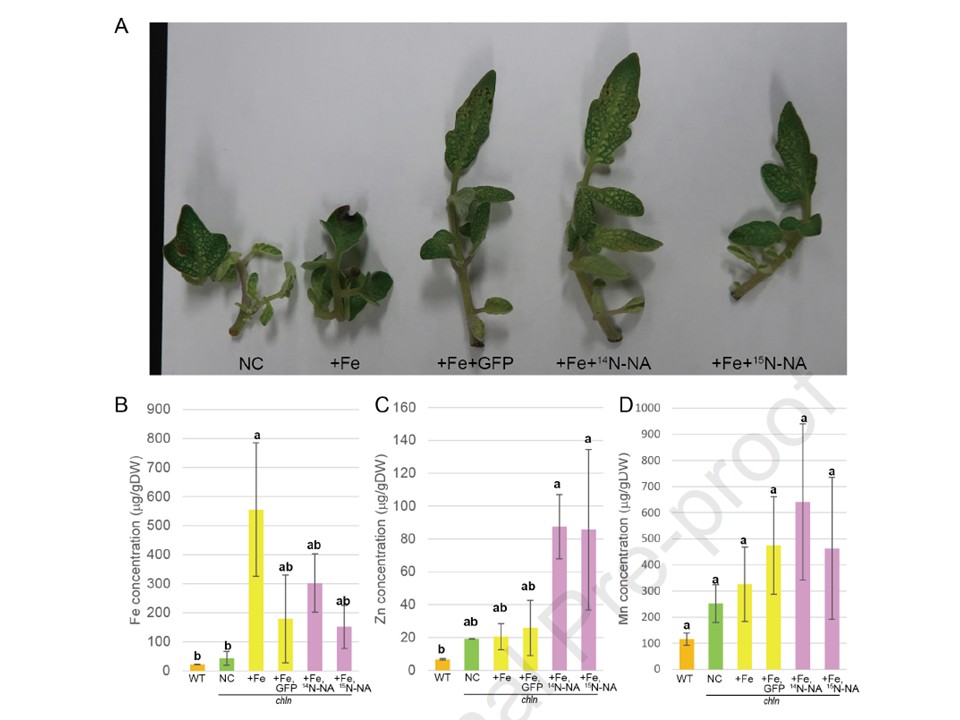
図1
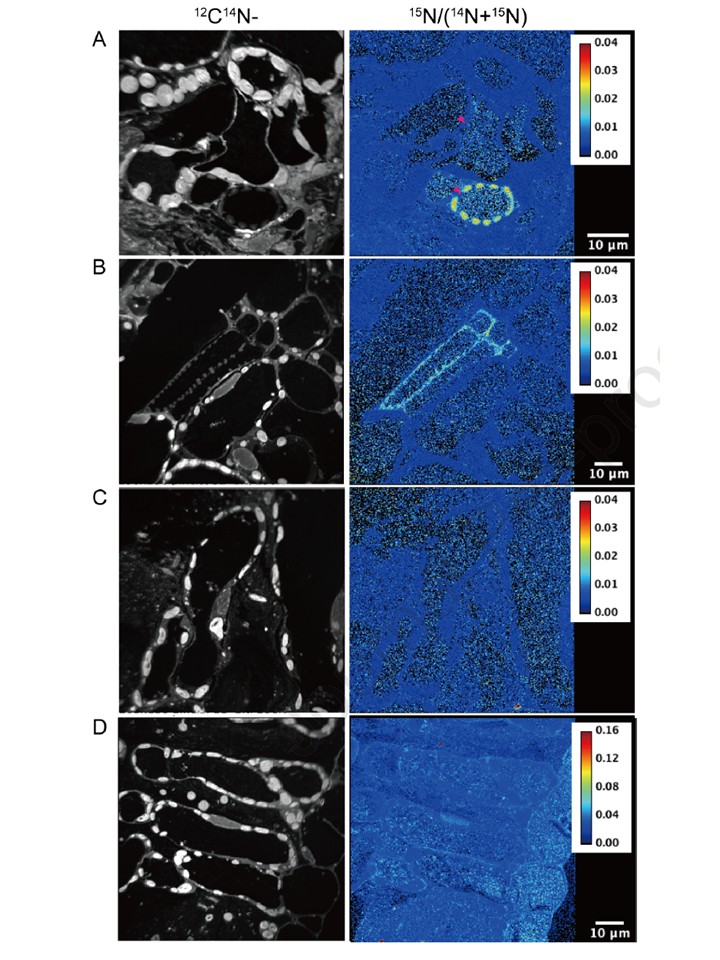
図2
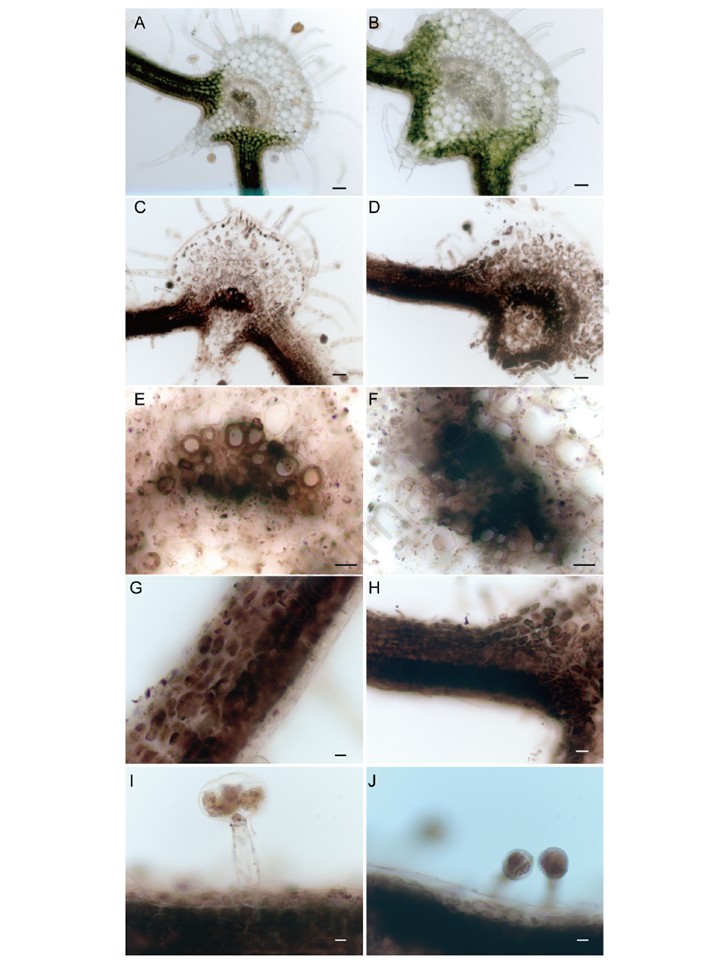
図3