シロイヌナズナ金属トランスセプターIRT1ループの金属センサー特性
シロイヌナズナ金属トランスセプターIRT1ループの金属センサー特性
Metal-sensing properties of the disordered loop from the Arabidopsis metal transceptor IRT1
Virginia Cointry, Reyes Ródenas, Nelly Morellet, Steven Fanara, Valérie Cotelle1, Julie Neveu and Grégory Vert
Biochemical Journal (2025) 482 451–466
要旨
植物鉄制御トランスポーター1(IRT1)は、鉄が制限された条件下で根に鉄を取り込む細胞膜タンパク質である。IRT1は、その主要な基質である鉄以外に、土壌の鉄が少なくIRT1が高発現している場合に植物に過剰蓄積する他の2価金属も輸送する。我々は、IRT1の非鉄金属基質による翻訳後制御に、膜貫通らせんTM4とTM5の間の細胞内制御ループが関与していることを以前に報告した。亜鉛が過剰になると、IRT1はCIPK23によるリン酸化を受け、続いてIDF1によってユビキチン化され、IRT1は液胞分解を受ける。この亜鉛依存的なIRT1のダウンレギュレーションには、IRT1ループに亜鉛と直接結合する4つのヒスチジン(H)残基が存在することが必要である。しかし、どのようにして選択的な金属結合が達成されるのか、また、どのようにして下流の制御が行われるのかは、ほとんどわかっていない。我々は、IRT1ループの金属結合特性と構造を明らかにし、非鉄金属センサーとシグナル伝達の分子基盤をより深く理解することを目指した。円偏光二色性とNMRの組み合わせにより、亜鉛とマンガンがナノモル領域の親和性でIRT1ループに結合すること、金属結合がループの構造化を引き起こさないことを明らかにした。我々は、亜鉛とマンガンの結合が4つのH残基によって媒介されることを検証し、アスパラギン酸(D)残基D173が金属配位を助け、植物におけるIRT1の金属感知と金属依存性分解に関与していることを同定した。以上の結果から、IRT1制御ループが細胞質内の高濃度の二価金属を感知し、植物における金属取り込みを制御していることが明らかになった。
(実験方法と結果は省略)
考察
変化する栄養供給量と栄養需要に対処するため、植物は栄養トランスポーターの発現を制御する戦略を開発した。これは、シロイヌナズナのIRT1鉄トランスポーターの場合であり、様々な金属基質によって異なるレベルで制御されている。すなわち、低Fe2+による転写制御と、Zn2+およびMn2+過剰による翻訳後制御である。以前、我々は、非鉄金属過剰に応答した細胞膜でのIRT1の翻訳後制御には、CIPK23キナーゼによるリン酸化と、それに続くIDF1 E3リガーゼによるK63ポリユビキチン鎖の付加が関与していることを示したが、この機構にはIRT1制御ループのヒスチジンに富んだモチーフが必要である。IRT1が金属を感知する分子機構をさらに深く理解するために、NMR分光法、CD分光法、MST解析、タンパク質予測アルゴリズムを組み合わせて、IRT1調節ループの構造基盤を調べた。その結果、IRT1ループは本質的に無秩序な領域(IDR)であり、様々なコンフォメーションをとることができることがわかった。この特性は、ヒトのZIP4亜鉛トランスポーターにも見られるように、ZIP間で保存されているようである。しかしながら、シロイヌナズナのMTP1液胞亜鉛トランスポーターのような他のトランスポーターファミリーも、金属結合モチーフを持つ無秩序な細胞内ループを持っているので、これはZIPの特異的な特徴ではない。我々の観察によると、IRT1ループはZn2+の存在下で小さな構造変化を起こすが、その大部分は無秩序なままである。この観察結果は、hZIP4で以前に報告されたように、IDRと小さなリガンドとの間に「ファジー」複合体が形成されることを示している。本質的に無秩序なタンパク質(IDP)やIDRの相互作用は、結合時に完全にフォールディングするものから、このような「ファジー」複合体を形成するものまで、さまざまなメカニズムを示すことがある。「ファジー複合体」とは、関与するIDPやIDRが結合時にコンフォメーションの柔軟性を保つような相互作用の一種を指す。従来の安定なタンパク質複合体とは異なり、これらの相互作用は動的な挙動を特徴とし、複合体は単一の、固定されたコンフォメーションをとらない。タンパク質におけるIDRの柔軟性とコンフォメーション可塑性が向上することで、パートナー間の相互作用や化学反応を促進する翻訳後イベントのためのプラットフォームが提供される。IRT1の場合、このような能力は、非鉄金属過剰時のIRT1ループリン酸化のために、CIPK23キナーゼのような下流因子のリクルートを促進する可能性がある。さらに、IRT1調節ループのヒスチジン残基が翻訳後調節において重要であることは以前にも証明されており、4つのヒスチジン残基を変異させたタンパク質を持つ植物は、非鉄金属過剰時にIRT1のリン酸化と分解を示さない。興味深いことに、調節ループのC末端に位置する残基の化学シフトが、Zn2+存在下と非存在下とで異なることが観察された。しかしながら、ヒスチジンの共鳴はZn2+の添加によって消失するため、この特定の伸張がこのような条件下で特異的なコンフォメーションをとるかどうかを決定することはできなかった。
IRT1へのZn2+とMn2+の結合について記録されたナノモル領域の解離定数は、過剰条件下で生育した植物において実験的に決定されたナノモル濃度の金属と一致している。重要なことは、ヒスチジンの伸張が、Zn2+とMn2+の直接配位にとって絶対的に重要であることを明らかにしたことである。驚くべきことに、2つのヒスチジン残基が変異してもIRT1ループはZn2+と結合できることがわかった。おそらく他の2つのヒスチジンとアスパラギン酸173が配位を担っているためであろう。このことは、ヒスチジンの二重変異体で得られたNMRデータからも支持され、残りの2つのヒスチジン残基とアスパラギン酸173のプロトン共鳴は、Zn2+存在下ではやはり消失した。Zn2+の配位数が3であることは一般的ではないが、Zn2+は大きなエネルギーペナルティーを受けることなく、様々な歪んだ配位構造をとることが記載されている。その上、アスパラギン酸残基144に対してAlphafoldサーバー3が予測したように、周囲の残基がZn2+の配位に寄与することで、IDRとしてのIRT1ループの柔軟性が、三重変異体H162A/H164A/D173NのZn2+結合能の残存を説明できるのではないかと推測している(オンライン補足図10)。
NMRとMSTによる観察から、IRT1の調節ループの5つの残基がZn2+を配位している可能性がある。すでに、2つのZn2+イオンが5つのイガンドによって配位され、リガンドの1つが橋渡しとして働くと報告されているので、IRT1ループにも2つのZn2+結合部位が存在する可能性がある。この仮説は、2つのZn2+イオンが存在するIRT1ループに対してAlphafoldサーバー3を用いて行った予測でも支持されており、そこではヒスチジン168が両方のイオンを配位する橋として示されている(図6)。残念ながら、IRT1ループに2つのZn2+結合部位が存在する可能性は、今回のデータでは区別できない。hZIP4のヒスチジンが豊富な細胞質ループで仮定されたように、おそらく単一のZn2+結合状態は存在せず、むしろZn2+結合状態は、ヒスチジン残基とアスパラギン酸173の複数の組み合わせによってZn2+が配位されたコンフォメーションアンサンブルである可能性が高く、細胞質Zn2+濃度に応じてIRT1内で過渡的なZn2+結合様式を可能にすると主張する。
我々はまた、Zn2+結合に関与する同じ残基が、おそらく隣接する残基とともにMn2+の配位にも関与していることを明らかにした。しかしながら、IRT1ループはMn2+よりもZn2+に対して高い親和性を示し、これはZn過剰に直面した植物で観察されるIRT1の強い分解と一致する。IRT1ループがZn2+、Mn2+、あるいはその両方を調整するかどうかは、金属イオンの利用可能性と相対的な細胞質局所濃度によって決まると思われる。
全体として、我々の研究は、ZIPトランスポーターの金属感知特性の解析のための枠組みを提供し、IRT1タンパク質がその制御ループを通してどのように金属を感知するのかについての理解を深めるものである。この理解は、植物がどのように鉄の取り込みを最適化し、植物組織における反応性の高い非鉄金属の吸収を制限しているかを把握し、植物における重金属蓄積を調節するバイオテクノロジー的アプローチを検討する上で極めて重要である。
図6の説明:IRT1調節ループによる亜鉛イオンとマンガンイオンの配位。IRT1ループがH162, H164, H166, H168, D173残基と配位するZn2+イオン(グレーの球)に対するAlphafold3の予測。緑色の破線は3.5Å以内の金属配位を示す。解析はUScf.ChimeraXアプリケーションで行った。IRT1, 鉄制御トランスポーター1。
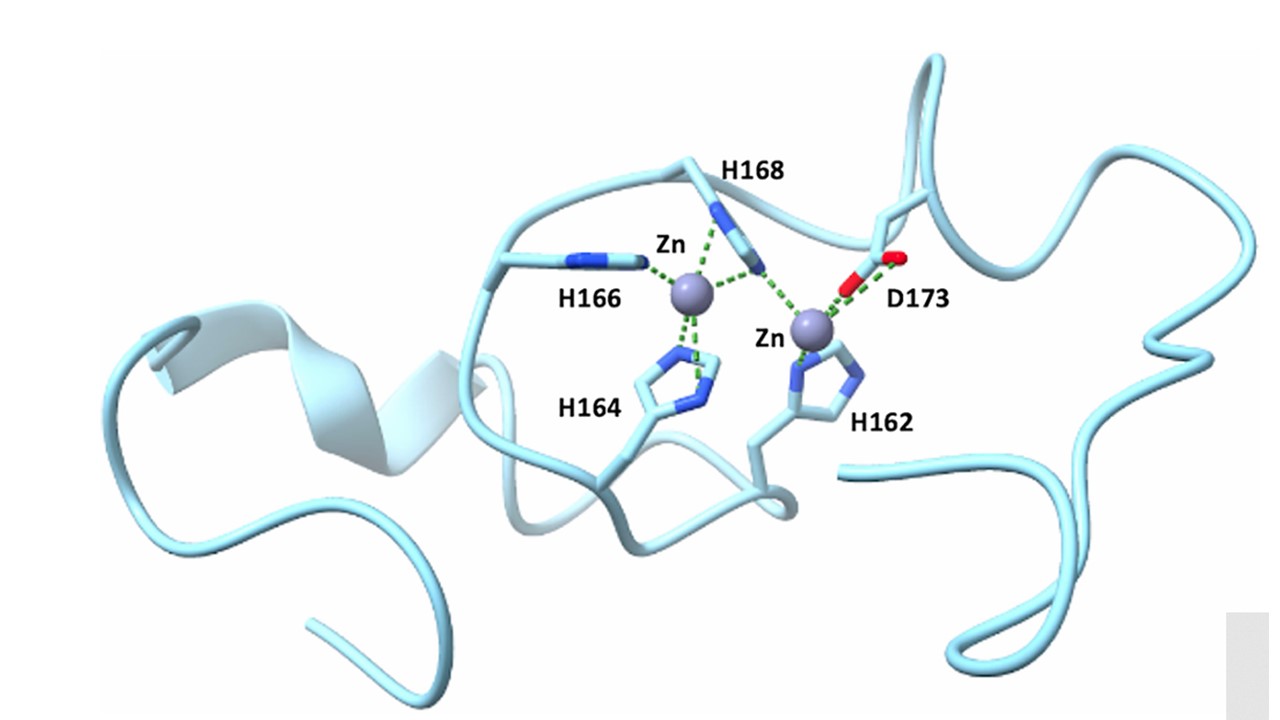
図6