活性タンパク質のユビキチン化は導管の機能を制御する
活性タンパク質のユビキチン化は導管の機能を制御する
Active protein ubiquitination regulates xylem vessel functionality
Pawittra Phookaew, Ya Ma, Takaomi Suzuki, Christina Stolze, Anne Harzen, Ryosuke Sano,中上 博文, 出村 卓, 大谷 美里
奈良先端科学技術大学院大学(〒630-0192 奈良県生駒市)理工学研究科生物科学専攻
東京大学大学院新領域創成科学研究科統合生命科学専攻
マックスプランク植物育種研究所 タンパク質質量分析部門
独立行政法人理化学研究所 環境資源科学研究センター
The Plant Cell, 2024, 36, 3298–3317
概要
木部維管束(導管)は陸上植物において水の長距離伝導に機能している。NAC転写因子VASCULAR-RELATED NACDOMAIN7(VND7)は、シロイヌナズナ(Arabidopsis thaliana)における導管細胞分化のマスターレギュレーターである。我々はこれまでに、VND7変異体によって誘導される異所性導管細胞分化抑制因子(seiv)を単離した。その結果、seiv3、 seiv4、seiv6、seiv9の責任遺伝子は、それぞれPLANT U-BOX46(PUB46)、未同定のF-BOXタンパク質(FBX)、PUB36、UBIQUITIN-SPECIFIC PROTEASE1(UBP1)をコードするタンパク質ユビキチン化関連遺伝子であることを報告した。また、seiv変異体では、VND7下流の遺伝子の発現が低下し、導管輸送活性に異常が見られた。VND7誘導により、492のタンパク質群のユビキチン化レベルが上昇し、180のタンパク質群のユビキチン化レベルが低下した。VND7誘導により、細胞壁生合成やタンパク質輸送に関わるタンパク質がユビキチン化されたが、seiv変異体ではこのような活発なタンパク質のユビキチン化は起こらなかった。我々は、VND7のK94、K105、K260の3つのリジン残基のユビキチン化を検出した。K94をアルギニンに置換すると、VND7の転写活性が著しく低下したことから、K94のユビキチン化がVND7の活性制御に重要であることが示唆された。この結果は、導管の活性制御における標的タンパク質のユビキチン化の重要な役割を明らかにするものである。
はじめに
陸上植物は特殊な脈管系を進化させ、木部脈管は水、栄養分、低分子分子を長距離シグナル伝達する上で主要な役割を果たしている(Lucas et al.) 木部管の細胞分化は、二次細胞壁(SCW)の肥厚とプログラム細胞死(PCD)によって特徴づけられる(Samuels et al.) SCWの沈着には、リグニン、セルロース、ヘミセルロースの生合成が関与する(Meents et al.) フェノール性高分子であるリグニンは、細胞壁の剛性を高め、植物の生物・生物ストレスに対する抵抗性を促進する重要な生体分子である(Fukuda 2004)。PCDの間、細胞内では核や細胞質を含むすべての細胞内構成要素が排除され、効率的な水分取り込みを可能にする中空チューブ構造になる(Fukuda 2004; Turner et al.) 導管分化の制御メカニズムを解明するために、様々な努力がなされてきた。その一つの突破口は、導管細胞分化のマスタースイッチ、すなわち植物特異的NAC(NAM/ATF1,2/CUC2)転写因子VASCULAR-RELATED NAC-DOMAINs(VNDs)の同定であった(Kubo et al.)。VNDは陸上植物間で広く保存されており、VND遺伝子は維管束植物の発達中の維管束組織で優先的に発現する(Kubo et al. 2005; Yamaguchi et al. 2008; Nakano et al. 2015; Akiyoshi et al.)。 VND7を過剰発現させると、その下流遺伝子の転写を介して、シロイヌナズナ(Arabidopsis thaliana)の異所性導管形成を強く促進した(Yamaguchi et al. 2010a)。その中にはセルロース合成遺伝子(IRREGULAR XYLEM5 [IRX5/CesA4]、RX3/CesA7、IRX1/ CesA8)、 リグニン生合成酵素(CAFFEOYL COENZYME A ESTER O-METHYLTRANSFERASE7[CCoAOMT7]とIRX12/ LACCASE4)、PCDのためのシステインプロテアーゼ(XYLEM CYSTEINE PEPTIDASE1 [XCP1])も含まれる。
逆に、VND7の転写活性を抑制すると、導管の形成に重大な影響を与えた(山口ら、2010b)。これらの知見は、導管細胞の分化におけるVNDの重要性を浮き彫りにしている。
導管細胞分化の制御因子を探索するため、我々はこれまでに、グルココルチコイド処理によりVND7が翻訳後活性化され、導管要素の分化を誘導するVND7-VP16-GR誘導系を導入したシロイヌナズナをメタンスルホン酸エチル(EMS)により変異導入した。VND7-VP16-GR変異株から、異所性導管細胞分化の欠損を示すサプレッサー変異体を単離し、VND7による異所性導管細胞分化誘導サプレッサー(seiv)と命名した。seiv1変異体では、S-NITROSOGLUTHIONE REDUCTASE 1(GSNOR1)の劣性変異により、タンパク質のS-ニトロシル化が誤って制御されていた(Kawabe et al.) seiv1における異所性導管形成の抑制は、VND7のトランス活性化活性に対するS-ニトロシル化の抑制効果に起因していた(Kawabe et al.)
この発見は、タンパク質の翻訳後修飾(PTM)を介した導管細胞の分化制御に関する洞察を与えるものである。8種のseiv優性突然変異体(seiv2〜seiv9)もまた、特に地上組織において、導管細胞の分化抑制を示した(Pawittra et al.) 本研究では、seiv変異体を用いて導管細胞分化の分子機構をさらに検討した。全ゲノムリシークエンス解析の結果、seiv3、seiv4、seiv6、seiv9の原因遺伝子は、それぞれPlant U-box型E3ユビキチンリガーゼ(PUB)タンパク質PUB46、UBIQUITIN-SPECIFIC PROTEASE 1(UBP1)、未同定のF-boxタンパク質(FBX)、PUB36をコードする遺伝子であることが同定された:これらの遺伝子はすべてタンパク質のユビキチン化に関連している。ユビキチノーム解析の結果、VND7に依存した導管細胞の分化過程では、ユビキチン化イベントが特異的に起こることが明らかになったが、seiv変異体ではこのようなユビキチン化ダイナミクスが阻害されていた。さらに、VND7の3つのリジン残基(K94, K105, K260)が導管細胞分化におけるユビキチン化部位として同定され、K94はVND7のトランス活性化活性を制御する上で重要な役割を果たしていることが明らかになった。今回の研究結果は、導管細胞の分化制御におけるタンパク質のユビキチン化の役割に関する知見を与えるものである。
図1. seiv変異体のDEXによる異所性導管細胞分化の抑制には、ユビキチン化関連遺伝子が関与している。
A)7日齢の苗をデキサメタゾン(DEX)で4日間処理した。DEX処理下では、VND7-VP16-GRの苗は青白くなって枯死したが、seiv変異体は生き残った。B) サンガー配列決定による候補遺伝子の検証により、PUB46、UBP1、FBX、PUB36の点変異が確認された。
対応するタンパク質内の予測アミノ酸置換位置を縦線で示す。C) デキサメタゾン(DEX)処理によるSEIV遺伝子の発現解析。VND7-VP16-GR苗を10μMのDEXで処理し、12時間ごとにサンプリングしてRT-qPCR解析を行った。PUB46、UBP1、FBXおよびPUB36の発現レベルは、内部コントロール遺伝子ACTIN2に対して正規化した。データは平均値±SDで示した(n =3)。D〜H) FBXプロモーターの発現パターン。FBXpro:GUSを導入した11日齢(D)と2日齢(E)の苗;11日齢のFBXpro:GUS苗の側根(G)と根の先端(F)の拡大画像。生後7日目の苗の根の横断面(H)。Bars=500 μm(E)、200 μm(D、G)、 100μm(F)、50μm(H)。各コンストラクトにつき少なくとも3つの独立した系統をアッセイした。
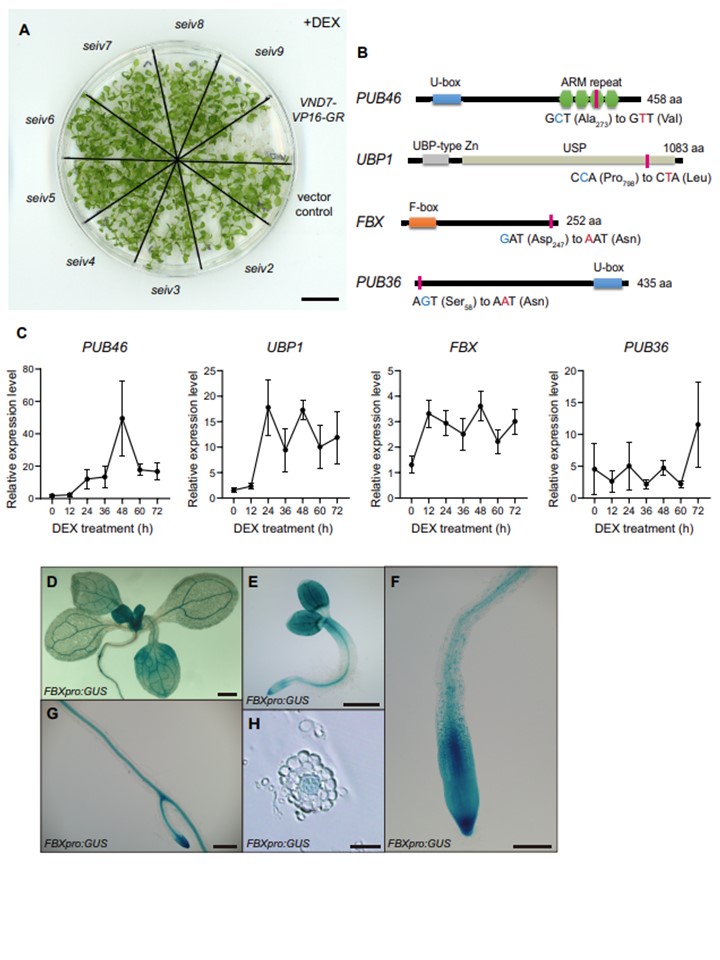
Fig1