転写因子Dof3.6/OBP3はシロイヌナズナの鉄ホメオスタシスを制御する
この研究ではOBP3というDofのホモログである転写因子が、最終的に鉄ホメオスタシスを制御していることを発見している。Dofは現在東大の生物生産工学センターの柳澤修一教授が1990年代末期に発見した遺伝子である。
転写因子Dof3.6/OBP3はシロイヌナズナの鉄ホメオスタシスを制御する
The transcription factor Dof3.6/OBP3 regulates iron homeostasis in Arabidopsis
徐培培(Peipei Xu)、楊依林(Yilin Yang)、趙中天(Zhongtian Zhao)、金博(Jinbo HH)、謝俊燕(Junyan Xie)、王力華(Lihua Wang)、鄭慧雄(Huiqiong Zheng)、蔡偉明(Weiming Cai
The EMBO Journal 13 November 2024
要旨
鉄は植物にとって必須元素である。植物による鉄の取り込みは高度に制御されているが、その根本的なメカニズムはよくわかっていない。鉄欠乏応答性bHLH100遺伝子プロモーターの切断断片を用いて、シロイヌナズナ転写因子酵母ワンハイブリッド(Y1H)ライブラリーをスクリーニングし、DOFファミリータンパク質であるOBP3が鉄欠乏シグナル伝達経路の重要な構成要素であることを同定した。OBP3は、C末端に活性化ドメインを持つ転写抑制因子である。その発現は鉄欠乏によって誘導される。OBP3を過剰発現させたトランスジェニック系統は鉄過剰と葉の早期壊死を示したが、obp3変異体は鉄欠乏に対する耐性が低かった。OBP3は、bHLH遺伝子プロモーターのIbサブグループを直接標的とすることが発見された。OBP3はbHLH転写因子であるILR3(IAA-LEUCINE RESISTANT3)と相互作用し、その相互作用によりOBP3のDNA結合能と転写促進活性が増強され、鉄欠乏応答遺伝子をポジティブに制御することがわかった。さらに、E3リガーゼBRUTUSは、26Sプロテアソームを介したOBP3タンパク質の分解を促進し、植物における過剰な鉄の取り込みを防いでいる。結論として、我々の研究は、植物の鉄ホメオスタシスの制御におけるOBP3の重要な役割を強調している。
考察
IbサブグループのbHLH遺伝子がシロイヌナズナの鉄欠乏応答に重要な役割を果たすことはすでに報告されていた(Sivitz et al, 2012)。我々は、bHLH100遺伝子プロモーターをベイトとして酵母ワンハイブリッドスクリーニングを行い、遺伝子上流の転写因子を同定した。スクリーニングの結果、多くの陽性コロニーが得られ、そのうちの7つは既知のIVcサブグループのbHLH遺伝子に属するbHLH100のプロモーターに結合した。他の2つの陽性クローンは、DOFファミリー転写因子OBP3であることがわかった。さらなる実験により、OBP3とILR3の両方がbHLH100プロモーターを活性化することが確認された(図1)。BP3はさらに、in vitroでのDNAおよびタンパク質結合特性を評価することによって特徴づけられた。この研究では、OBPを大腸菌で発現させた。図1Dに示すように、OBPはbHLH100プロモーターのA/TAAAGエレメントに結合した。各AAAGモチーフに2bpの変異を含む変異型AAAGエレメントにはどのOBPも結合せず、このエレメントに対する特異性が示された(図6A,B)。過去の文献によると、OBPはシロイヌナズナGST6プロモーターのCTTT[T/A]エレメントにも同様に結合できる(Kang et al, 2003; Kang and Singh, 2000)。
植物特異的ジンクフィンガータンパク質ファミリーには、特定のbZIPタンパク質、高移動度グループ(HMG)タンパク質および他のDOFタンパク質と相互作用するDOFタンパク質が含まれる(Yanagisawa, 2002)。OBPタンパク質間の相同性は52アミノ酸のDOF結合ドメインに限られている。これが唯一の共通配列であることから、このドメインはDNA結合やタンパク質間相互作用など、複数の機能を持つ可能性がある。OBPタンパク質のDNA結合特性はin vitroで類似しており、bZIP転写因子OBF4と相互作用することができる。この結果は、トウモロコシDOFタンパク質のDNA結合とHMGタンパク質との相互作用にDOFドメインが必須であるというYanagisawa (1997)の知見と一致している(Yanagisawa, 2002)。ジンクフィンガードメインは他のタンパク質でも多機能であることが示されている。柳澤によると、トウモロコシDOF1タンパク質のトランス活性化活性は、キサントゲン化プロトプラストでは阻害されたが、緑色プロトプラストでは阻害されなかった(Yanagisawa, 2000)。トウモロコシPBFはbZIPタンパク質Opaque2と相互作用する(Zhan et al, 2018)。タンパク質間の相互作用は特異性にも寄与し、組織特異的な発現パターンによってさらに増強され、組織ごとに異なる転写プロファイルをもたらす。
また、トウモロコシDOF1タンパク質がトウモロコシC4ホスホエノラーゼプロモーターの複数のDOF結合部位を介してトランス活性化因子として働くのに対し、トウモロコシDOF2タンパク質はDOF1トランス活性化の抑制因子として機能することが柳澤によって示されている(Yanagisawa, 2000, 2002)。OBP3タンパク質は、複数のDOF結合モチーフを含む下流遺伝子プロモーターを持つレポーター遺伝子を有意にトランス活性化することは観察されなかった。この結果については、OBP3が転写活性化因子としてではなく、転写阻害因子として働いた可能性など、いくつかの説明ができる。しかしながら、GAL4 DNA結合ドメインと融合したOBPのN末端を欠失させたものは転写活性を示したことから、OBPはラン活性化ドメインを含んでいることが示された。これらの領域には、トウモロコシDOF1(Cavalar et al, 2007)で観察されたような、既知の活性化ドメインとの相同性は確認されなかった。OBP3を過剰発現させたトランスジェニック植物により、このタンパク質が植物の発生において重要な役割を果たしていることが以前に示されている(Kang et al, 2003)が、この遺伝子の真の機能は依然として不明である。今回の研究では、OBP3が鉄ホメオスタシスの重要な制御因子であることを明らかにした(図9)。
さらに、OBP3過剰発現による過剰鉄の蓄積と鉄ホメオスタシスのバランスが、35S::OBP3 lantの葉のクロロシスと矮性表現型の主な原因であることを明らかにした(図2)。さらに、この変異苗は、十分な鉄分を含む1/2MS培地では良好に生育したが、鉄欠乏培地や鉄の生物学的利用能の低いアルカリ性土壌では異常な生育を示したことから、OBP3が鉄のホメオスタシス制御に関与していることが示された。OBP3はDOF認識配列[A/T] AAGに特異的に結合し、転写を活性化する(Kang et al, 2003)。我々は、OBP3が主要な鉄ホメオスタシス1bサブグループのbHLH遺伝子と植物の成長をポジティブに制御していることを発見した(図4)。
この発見は、鉄欠乏環境下で鉄同化の正確な層別制御をシグナルする鉄欠乏カスケードが、これまでの観察結果と一致している。obp3およびilr3変異体の根の表現型は、鉄が十分な条件下では野生型と類似しているが、低鉄条件下では欠損しているという観察結果は、これら2つの調節遺伝子が鉄欠乏シグナル伝達経路において特異的な役割を果たしていることを示唆している。OBP3結合強度は、bHLH100を含むILR3が存在する場合、in vivoで増加する(図6D)。さらにin vitroでは、ILR3bHLHが結合した結果、OBP3DOFはDOF結合部位の両方が変異したDNA断片に結合する。このことは、DNAのアロステリーが、ILR3bHLH-DNA複合体に対するOBP3DOFの親和性を高めている可能性を示唆している。TFは、特定の塩基配列との直接的な相互作用と、DNAの屈曲や巻き戻しといった局所的なDNAの特徴を認識することの両方によって、DNA結合部位を認識する。われわれは、ILR3がDNA結合を増強し、DNAの局所的な形状を変化させることで、OBP3のDNAへの結合が増強されると考えている。OBP3が生体内でILR3の結合に影響を及ぼすかどうかについては、実験を行う必要がある。bHLHファミリーTFは四量体を形成することが示されている。これらの四量体は、PIF4四量体(Gao et al, 2022b)で示されているように、DNAループ形成を促進し、近傍のOBP3結合を増加させる可能性がある。ILR3とOBP3タンパク質の相互作用は、機能的なヘテロ二量体の形成につながる可能性があり、このヘテロ二量体は低鉄条件下で蓄積し、鉄欠乏下では取り込みを促進する。
BTSを介したユビキチン化がOBP3の分解につながるかどうかを評価するため、シロイヌナズナのプロトプラストにBTS-GFPとFlag-OBP3を共導入した。Flag-OBP3タンパク質レベルはBTS-GFPとともに有意に減少したが、発現レベルは減少しなかった。26Sプロテアソーム阻害剤である50μM MG132で処理すると、FlagOBP3レベルは回復した(付録図S9)。このことは、BTS1がin vivoにおいて26Sプロテアソーム経路を介したOBP3の分解を促進することを示している。つまり本研究は、BTSが26Sプロテアソームを介するDOF転写因子OBP3とbHLH転写因子ILR3を特異的に標的とし、それによってILR3とOBP3タンパク質が関与するヘテロ二量体複合体の形成を阻害することを示す経験的証拠を提示した。その結果、この干渉は、鉄欠乏応答遺伝子が制御する下流の鉄欠乏応答遺伝子の制御を乱す可能性がある。さらに、BTSも鉄欠乏状態では蓄積し、OBP3/ILR3を介した応答を阻害する可能性がある。このように鉄欠乏応答を微調整することで、過剰に鉄を取り込むことなく、適切な鉄吸収を保証し、結果として根全体の成長に影響を与える。全体として、今回の結果は、鉄欠乏がどのように植物遺伝子の発現を制御し、それがどのように正常な成長に寄与するのかについての理解を深めることに貢献するものである。
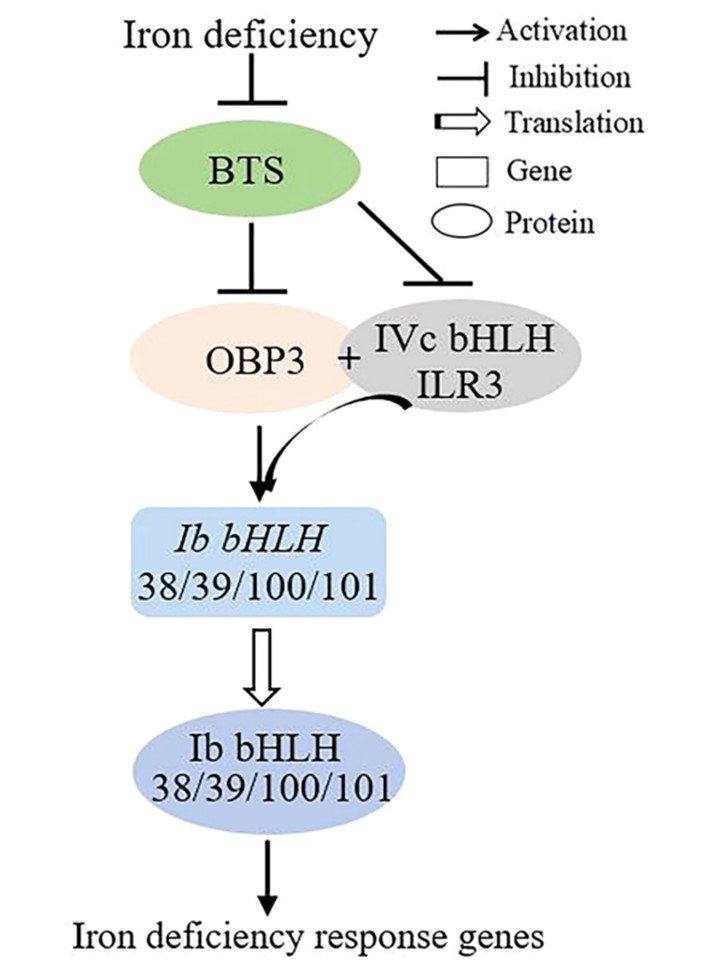
図9.
OBP3がシロイヌナズナの鉄ホメオスタシスを調節する作業モデル。
このモデルは、シロイヌナズナの鉄ホメオスタシスにおけるOBP3とILR3の分子機能を示している。OBP3はILR3と相互作用し、IbサブグループbHLH遺伝子のプロモーターに結合して発現を制御する。OBP3はLR3(IAA-LEUCINE RESISTANT3)と相互作用し、その相互作用によってOBP3のDNA結合能と転写促進活性が増強され、その結果、鉄欠乏応答遺伝子の発現がポジティブに制御される。転写後レベルでは、E3リガーゼBRUTUS (BTS)が26Sプロテアソーム機構によるOBP3とILR3タンパク質の分解を補助し、過剰な鉄の取り込みを防ぎ、植物における鉄の恒常性を維持している。中心的な制御タンパク質を楕円で、下流の標的遺伝子を四角で表す。