高濃度CO2に対する植物の応答は遺伝性であり、DNAメチル化によって制御される
環境ストレスに対して植物がそれに対する耐性を遺伝させるかどうかは、ミチューリン・ルイセンコ学派の時代から、引き継がれている課題である。ルイセンカコがあまりにもスターリン寄りで政治的な権力的な振舞をしたがゆえに、スターリン無きあとは、彼らの獲得形質の遺伝説は、1950年代にワトソン・クリックによる二重らせんモデルが提唱されて、完全に否定された(この説を受け継ぐ学派は馬鹿にされ、日本では消滅した)。しかし、近年epigenetic 遺伝子の存在が発見されて、この獲得形質の遺伝の影響の実態解明が植物の分野でも飛躍的に進行している。ここに紹介する論文はその一端である。
高濃度CO2に対する植物の応答は遺伝性であり、DNAメチル化によって制御される
The plant response to high CO2 levels is heritable and orchestrated by DNA methylation
Kaushik Panda1, Boominathan Mohanasundaram1, Jorge Gutierrez1, Lauren McLain1, S. Elizabeth Castillo1, Hudanyun Sheng1, Anna Casto1, Gustavo Gratacos2, Ayan Chakrabarti2, Noah Fahlgren1, Sona Pandey1, Malia A. Gehan1, R. Keith Slotkin1, 3 1 Donald Danforth Plant Science Center, St Louis MO 63131, 2 Washington University of St. Donald Danforth Plant Science Center, St Louis, MO 63132, USA; 2 Department of Computer Science & Engineering, Washington University in St Louis, St Louis, MO 63130, USA; 3 Division of Biological Sciences, University of Missouri, MO 65211, Columbia, USA
New Phytologist (2023) doi: 10.1111/nph.18876
概要
生物学的環境に対する植物の反応は、最初のストレスにさらされた後、植物に持続的な影響を与えることが知られています。
これらの持続的な影響の中には、次の世代に影響を与える世代間影響もあります。
二酸化炭素(CO2)濃度の上昇に対する植物の応答は、よく研究されています。
しかし、これらの研究は、通常、高CO2環境で一世代だけ栽培された植物に限定されており、世代を超えた研究はほとんど行われていません。
私たちは、高濃度二酸化炭素に暴露された植物の世代を超えた成長反応を明らかにするため、二酸化炭素濃度を基準値に戻したときの直系子孫を調査しました。
その結果、開花植物であるシロイヌナズナと種なし非脈管植物であるPhyscomitrium patensは、高CO2に暴露した植物の子孫において、引き続き成長速度の加速を示すことがわかりました。
我々は、モデル種であるシロイヌナズナを用いてその分子機構を解明し、この成長反応の遺伝性にはDNAメチル化経路が必要であることを見出しました。
具体的には、メチル化を開始するためにはRNA指向性DNAメチル化経路が必要であり、このDNAメチル化が子孫植物に世代を超えて伝播するためには、CMT2およびCMT3というタンパク質が必要であることを明らかにしました。
これら2つのDNAメチル化経路は、高濃度CO2曝露に対する細胞記憶を確立し、それを維持します。
はじめに
大気中の二酸化炭素(CO2)濃度は、過去60年間に急速に上昇し、現在は季節によって412〜421ppmの間にある。2100年には1000ppmに達するという予測もある。
CO2レベルの上昇に対する作物、森林、研究用植物の生理的および発達的反応は、よく研究されている。
植物界全体では、C3植物がCO2レベルの上昇にさらされると、成長反応が促進され、地上部が増加することが分かっている。
葉などの器官も大きくなり、CO2濃度の高い対照植物の成長を上回ることがある。
このような成長の増加のメカニズムとして、C3植物の光合成における炭素同化の効率が高くなることが知られている。
植物では、温度や乾燥などの生物学的ストレスが、ストレスにさらされた後にも持続するストレス応答を引き起こすことが知られている。
例えば、苗の段階で植物が克服できるような熱ストレスを与えることで、発育後のより深刻な熱ストレスに耐えられるようにすることができる。
このような反応は一世代で起こるもので、「プライミング」と呼ばれる。
ストレスに対するプライミングは、農作物のストレス耐性を向上させるために農業的に利用されている。
また、植物は一世代でプライミングを行うだけでなく、ストレスの細胞記憶が子孫に伝わる「世代間遺伝」を行う。
動物とは異なり、植物は発生初期(哺乳類では子宮内)に生殖細胞を隔離して保護することはない。
その代わりに、成長する植物の先端にある植物分裂細胞が、発生後期に分化して、次の世代を形成する生殖細胞を生成する。
このため、植物の生殖細胞は潜在的なストレスに長くさらされ、次世代に続く遺伝子発現状態に影響を与える。
生殖細胞の分化の場所と時期から、世代を超えたエピジェネティックな遺伝は、哺乳類ではまれであるが、植物界では広く見られる。
植物では、世代を超えたエピジェネティックな遺伝子を受け継ぐ分子機構が解明されている。
遺伝は、シトシン塩基にDNAのメチル化マークを付けることに依存している。
これらのメチル化マークは遺伝子発現に影響を与え、生殖中に伝播し維持されることができる。
DNAメチル化の遺伝性は、DNA合成後にメチル化マークを忠実に伝播させるDNAエチル化酵素タンパク質に依存しており、各細胞分裂周期でメチル化マークが伝播する。
DNAメチル化酵素の変異体では、世代を超えたエピジェネティックな情報は次世代に伝わらない。
植物には、4種類のDNAメチル化酵素が存在する。
MET1はCG配列のメチル化されたシトシンを伝播し、CMT2とCMT3はそれぞれCHHとCHG配列のDNAメチル化を触媒する(ここでHはG以外の任意のヌクレオチドを表す)。
ヒストン修飾とコンパクションは、CMT2およびCMT3メチルトランスフェラーゼをゲノムのトランスポーザブルエレメント(TE)や繰り返し領域に誘導することによって、DNAメチル化レベルに直接影響を与える。
植物ゲノムのDNAメチル化レベルを維持するメチル基転移酵素MET1、CMT2、CMT3に加え、RNA-directed DNA methylation(RdDM)と呼ばれるメカニズムが、新しいメチル化マークを付けるために作用している。
RdDMでは、RNAポリメラーゼIVタンパク質(Pol IV)によってゲノムの繰り返し領域から低分子干渉RNA(siRNA)が生成され、このsiRNAがデノボメチル化をターゲットとして機能する。
DNAメチル化の維持とは異なり、RdDMによって付加されるメチル化は、どのシトシン配列のコンテキストにも特異的ではない。重要なことは、MET1、CMT2、CMT3、RdDMが同時に同じ遺伝子座をメチル化できるように、DNAメチル化機構は相互に排他的ではないことである。
4つの研究により、生物学的ストレス因子と同様に、CO2レベルの上昇は植物の成長に世代を超えた影響を与えることが判明した。
しかし、これらの研究はいずれも、世代交代反応を引き起こすメカニズムについて調べたものではない。
我々は、シロイヌナズナにおいて、高CO2環境に対する植物の世代間応答が起こるかどうかを明らかにすることを目的とした。
植物を高CO2レベルに曝露し、常温のCO2レベルに戻したときの子孫の生育を試験した。
シロイヌナズナを用いて、高CO2反応の遺伝性の確立と維持に関わる分子メカニズムを解明した。
また、シロイヌナズナから4億9400万年〜5億1500万年離れた非通導組織植物Physcomitrium patensの高CO2成長応答を調べることで、この世代を超えた遺伝性の進化的幅を検証した。
(最後の章のみ訳す)
CO2応答性メチル化の遺伝性とその影響
cmt2/3変異体におけるCO2応答性メチル化の存在は、遺伝性の成長応答におけるメチル化の役割を調査する能力を与えてくれた。その結果、CMT2とCMT3が寄与するCHG/CHHコンテクストDNAメチル化が、CO2応答性DNAメチル化の子孫世代への遺伝性に必要であることがわかった。このことは、RdDMがCO2応答性DNAメチル化を確立するのに十分であるにもかかわらず(前節で述べた)、このDNAメチル化を次世代に遺伝的に維持するためには、CHG/CHHコンテキストの伝播が必要であることを示している。さらに、cmt2/3変異体は次世代で成長促進を示さないことから、CHG/CHHメチル化の維持が成長応答の遺伝性に必要であることが示された。DNAメチル化変異体におけるメチル化配列決定と成長応答を組み合わせた我々のデータは、RdDMと維持DNAメチル化経路の両方が、CO2濃度上昇に対する遺伝性の成長応答に必要であるが、その作用のタイミングは異なることを示している。図7(a)に我々のモデルで示したように、RdDMは高CO2に直接曝された植物でDNAの過剰メチル化を引き起こし、図7(b)では、このDNAメチル化は高CO2に直接曝された植物の成長応答には必要ではなく、図7(c)では、RdDMによる確立後、このメチル化はCMT2およびCMT3によって次世代に維持され、図7(d)では、RdDMとCMT2およびCMT3による維持メチル化の両方が、子孫において加速された成長応答を継続するために必要である。今後の研究では、高CO2環境の細胞記憶を保持するRdDMとCHG/CHH維持メチル化の両方の遺伝子標的に焦点を当てる。
(以下紙面の都合で図1,3,7ののみを示したが、図1から図7までの説明文はすべて訳しておいた。)
図1 シロイヌナズナにおける高CO2誘発成長促進の実験デザインと遺伝率。(a)実験デザイン。植物は全ライフサイクルを常温(青、450-500ppm)または高CO2(赤、1000ppm)で生育させた。高CO2で栽培された植物の子孫のみが第2世代で栽培される。これらの第2世代植物は、常温CO2条件下で栽培される。(b) シロイヌナズナ植物のトップダウンイメージングは、Raspberry Piコンピューターで制御されたカメラを用いて自動的に収集された。PLANTCVとパッケージPLSEGを用いて、緑色植物の面積を特定し(左)、個々の植物をセグメント化し(中央)、個々の植物の表面葉面積を計算した(右)。シロイヌナズナの代表的な平面を示す。(c) 植え付け後8日目から22日目(DAP)までの、1時間ごとに測定した緑色植物の表面積(pixel2 )。すべての成長曲線について、実線は少なくとも96株の平均を示し、各線の周りの半透明の領域は平均の95%信頼区間を示す。(d) 高CO2で生育させた子孫植物(cの紫線)と親植物(cの赤線)の植物面積の変化(D)。この変化線の値がゼロであれば、高CO2での親株の成長と比較して、子孫の成長が同じであることを示す。
図2 Physcomitrium patensにおける高CO2成長応答の遺伝性。(a)常温または高CO2条件下で35日間生育させたP. patensの代表的な画像。第2世代は、常温または高CO2条件下で生育させた親株からの子孫株を示す。シロイヌナズナの生育条件と同様に、第2世代の植物はすべて常温CO2条件下で生育している。バーは2mm。(b)aで説明した実験デザインによる植物面積の測定。各条件で少なくとも10株を画像化した(データ点は塗りつぶした円で示す)。箱はデータの75パーセンタイルと25パーセンタイルを表し、ひげは90パーセンタイルと10パーセンタイルを表す。中央値はボックスを横切るバーで、平均値は菱形で示す。P値はt検定で計算
図3 高CO2で生育したシロイヌナズナにおけるDNAメチル化の差。(a) 高CO2で生育させた植物の2つの生物学的複製で同定されたメチル化領域のベン図(青と緑)。重複するDMRは、「ノイズ」として分類されたゲノムの領域(赤で示され、Supporting Information Fig. これらのDMRは、子孫植物で観察されたメチル化変化に基づいて、遅延型、一過性、または持続型に分類された。(b) (a)で持続性に分類されたハイパーDMRの解析。すべてのメチル化解析において、同じ色の個々の線は異なる生物学的複製を表す。メタプロットは、すべてのDMRにわたる平均メチル化レベル(実線)とSE(半透明領域)を表示する。DMRはスケールされ、両端(開始と停止)で整列され、両側の300ヌクレオチド(nt)が表示に含まれる。メタプロットの下のヒートマップは、右のスケールに基づいた各DMRのメチル化レベルを表示する。左の高CO2植物は右の子孫サンプルの親である。(c) (a)で持続性と分類された低DMRの解析。データの表示は(b)と同じ。
図4 持続的メチル化領域(DMR)の解析。(a)シロイヌナズナゲノム(紫色)のアノテーションをオーバーラップして測定した、持続性の高いDMR(左)と低いDMR(右)の特徴表現。同じサイズのランダムセットは、偶然に予想される特徴の重複率を示している(青;「材料と方法」のセクションを参照)。他のアノテーション特徴との重複は、Supporting Information Fig. (b)シトシンコンテキスト別の持続性hyperDMRのメチル化レベル。CNNはすべてのシトシン配列コンテクストを表し、HはG以外のヌクレオチドを表す。メタプロットは、すべてのDMRにわたる平均メチル化レベル(実線)とSE(半透明領域)を表示する。DMRはスケールされ、両端(開始と停止)で整列され、両側の300ヌクレオチド(nt)が表示に含まれる。
図5 シロイヌナズナ変異体における高いCO2応答性成長。(a)さまざまな変異体の組み合わせで解析されたタンパク質の機能。カラーコードは(b, c)に続く。(b) 各変異体の組み合わせについて、常温と高CO2で生育させた植物間の植物面積の変化(D)。この変化線の値がゼロであれば、植物は高CO2に対して成長反応を示さないことを示す。この変異体の組は、野生型(WT)と比較して、高CO2に対して同レベルの成長促進ができなかった。(c) (b)と同じであるが、この突然変異体群は、WTと比較して、高CO2に対して同程度かそれ以上の成長促進を示した。(b,c)の成長曲線について、実線は少なくとも96株の平均を示し、各線の周りの半透明の領域は平均の95%信頼区間を示す。
図6 高CO2で生育させた変異シロイヌナズナの子孫の解析。(a)図3(a)で定義した持続的メチル化領域(DMR)にわたるddm1変異体のDNAメチル化のメタプロット。図3の野生型(WT)の常温(青)と高CO2(赤)におけるDNAメチル化レベルを参考として示した。高DMRでのメチル化を左に、低DMRでのメチル化を右に示す。(b) 持続性DMRにわたるpol IV変異体のDNAメチル化のメタプロット。(c) cmt2/3変異体の持続性DMRにわたるDNAメチル化のメタプロット。(d)持続性超DMRにわたるcmt2/3変異体のすべてのシトシン配列コンテキストのメチル化を示すメタプロット。(e)持続性DMRにわたるcmt2/3変異体の子孫におけるDNAメチル化のメタプロット。親世代は高CO2で生育させ、子孫植物は常温CO2で生育させた。メタプロットは、すべてのDMRにわたる平均メチル化レベル(実線)とSE(半透明領域)を表示する。DMRはスケールされ、両端(開始と停止)で整列され、両側の300ヌクレオチド(nt)が表示に含まれる。(f)高CO2で生育させた子孫植物とその親植物との植物面積の変化(D)。WTのデータはFig.1(d) 実線は少なくとも96株の平均を示し、各線の周りの半透明の領域は平均の95%信頼区間を示す。
図7 高CO2に対する遺伝的成長応答におけるDNAメチル化の役割のモデル。(a)高CO2レベルでは、野生型(WT)植物は成長が加速され、ゲノムのいくつかの領域がRNA指向性DNAメチル化(RdDM)によって過剰にメチル化される。黒矢印はRdDMによる遺伝子(枠で示す)のメチル化を示す。(b)RdDM変異体では、WTで観察された高メチル化なしに、高CO2に対する成長促進応答が存在する。 (c)WTでは、高CO2で観察された成長促進は子孫植物に遺伝するが、高CO2で得られたメチル化は維持メチル化機構によって伝播する。(d) pol IVのようなRdDM変異体では、高CO2下で観察された成長促進はもはや遺伝しない。維持メチル化変異遺伝子型cmt2/3では、WTで観察されたCO2応答性のメチル化増加も成長促進も、次世代には伝播しない。したがって、成長促進表現型の遺伝性には、メチル化を確立するRdDMと、メチル化を次世代に伝播させる維持機構の両方が必要である。図はBioRender.comで作成。
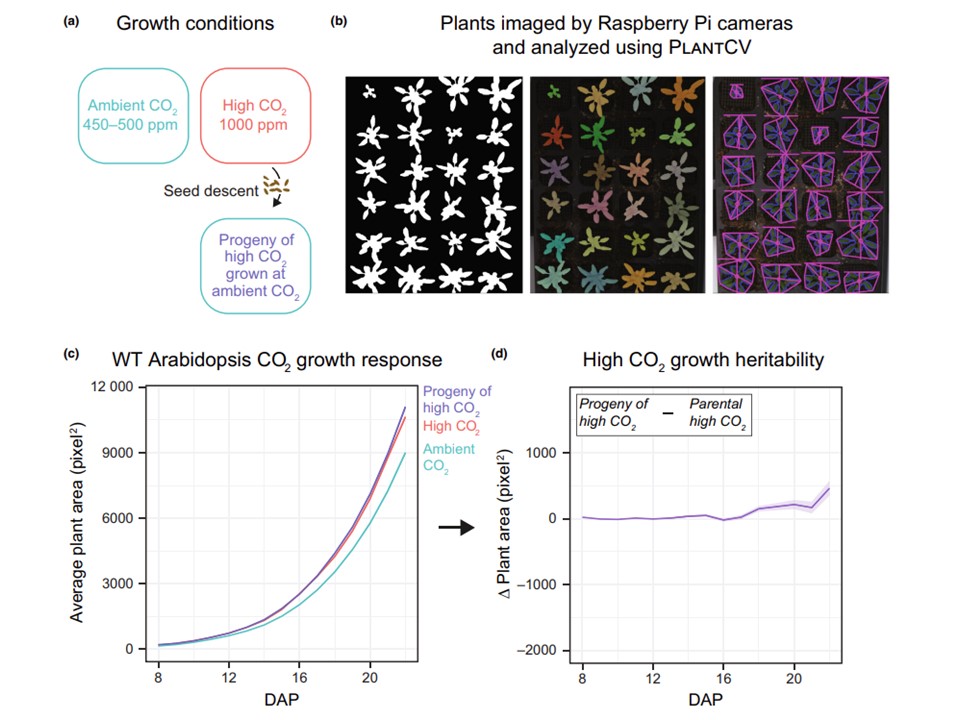
図1
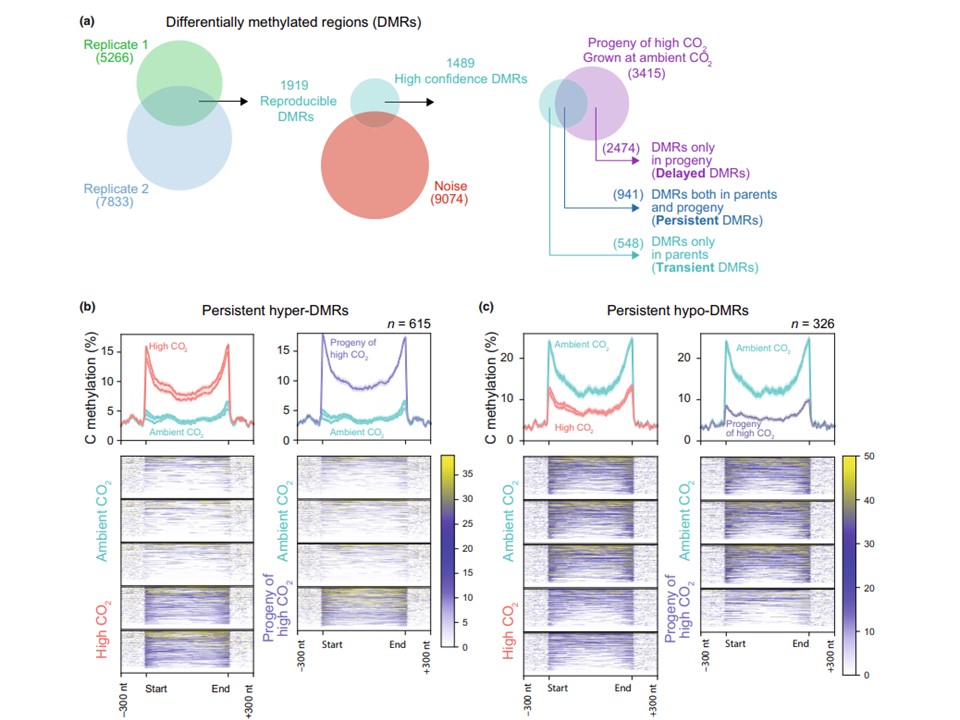
図3
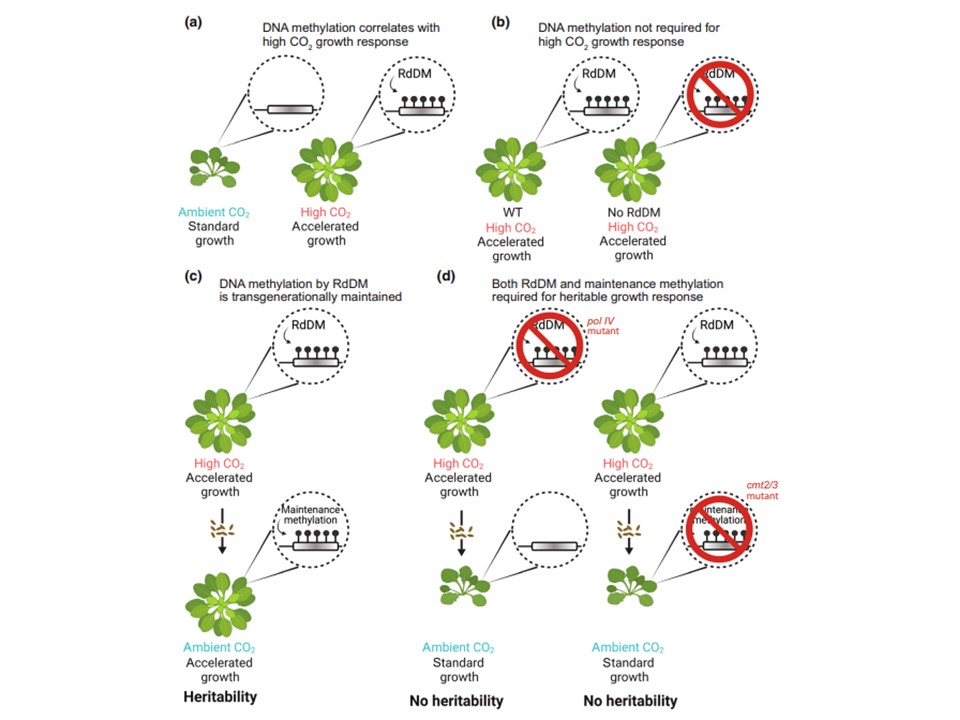
図7