IMA1の空間的な制御はMAMPを認識することにより根による鉄獲得を制限する
IMA1の空間的な制御はMAMPを認識することにより根による鉄獲得を制限する
Spatial IMA1 regulation restricts root iron acquisition on MAMP perception
Nature
https://doi.org/10.1038/s41586-023-06891-y
Received: 14 October 2022
Accepted: 22 November 2023
Published online: 10 January 2024
概要
鉄は宿主と微生物の相互作用において重要である。感染時に宿主が利用可能な鉄を制限することは、栄養免疫と呼ばれる重要な防御戦略である。しかし、腸管上皮や植物の根の表皮のように、鉄の生物学的利用能に有利な環境を作り出す、外部に面した吸収性の組織にとっては、これは難問である。例えば、植物の根は主に土壌から鉄を吸収し、鉄が不足すると、根圏の酸性化や鉄キレート剤の分泌などのメカニズムによって鉄の利用率を高める。しかし、鉄の生物学的利用能の上昇は、植物の健康を脅かすバクテリアの増殖にとっても有益である。ここで我々は、シロイヌナズナにおいて、フラジェリンなどの微生物関連分子パターンが、全身の鉄欠乏シグナルペプチドであるアイアンマン1(IMA1)の局所的な分解を通じて、根の鉄獲得抑制につながることを報告する。
この反応は、細菌が根組織に侵入したときにも誘発されるが、細菌が根の外表面に生息しているときには誘発されない。IMA1自身は、根とシュートにおける免疫を調節する役割を持ち、根のコロニー形成レベルと細菌性葉面病原体に対する抵抗性に影響を与える。我々の発見は、鉄の生物学的利用能と取り込み、および免疫応答に影響を与える栄養免疫の適応的分子メカニズムを明らかにした。
考察
我々の結果は、flg22 MAMPが長期間存在すると、A. thalianaにおける鉄欠乏応答の主要な構成要素が消失することを明らかにした。
生物学的に利用可能な鉄を根に輸送し、隔離することで、潜在的な病原体から鉄を奪うことができるのに、これは不可解に思える。しかし、このような応答は、生物学的に利用可能な鉄が環境中に乏しい場合にのみ起こる(そうでなければ、植物は鉄欠乏にならない)ので、鉄結合化合物やプロトンを滲出させることによって鉄を生物学的に利用可能にし続けることは、病原体にも利益をもたらすかもしれない。
以上のことから、IMA1を介した鉄欠乏応答とflg22を介した防御応答との間の拮抗機能は、潜在的な病原体にとって鉄が生物学的に利用可能になることを避け、植物の防御応答を損なわないために重要である可能性が示唆された。我々の発見はまた、鉄欠乏応答の調節は、単に細菌が存在することによって引き起こされる構成的な応答ではなく、脅威を示す合図(例えば、高レベルのflg22の持続的な存在や組織損傷)の存在に応じて引き起こされるものであることを示している。一般に酸性(還元性)条件とクマリンは根圏での鉄溶解性を促進するため、鉄が制限された条件下で健全な根圏を維持するには、このようなきめ細かな調節が重要であると思われる。鉄の獲得を停止することは、有害な細菌が鉄に容易にアクセスできるようにすることを避ける方法かもしれないが、同時に、植物自身や有益な細菌が利用できる鉄を制限することになる。しかし、根圏における鉄の利用可能性を制限することは、一般的に、根圏に生息する細菌の病原性を促進する危険性がある。もしそれが、代謝の協同性と鉄のレベルが病原性を抑制することが示されている哺乳類の腸内の状況に似ているのであれば。栄養ストレス応答と植物免疫系の密接な関連は、リン酸に対する植物の応答で観察されており、栄養獲得と植物免疫応答の一般的で複雑な絡み合いを示唆している。鉄と免疫系をつなぐパイプ役として、IMAは一連の複雑で多面的な機能を仲介する重要な成分であるようだ。一方では、IMAの局所分解によって根の酸性化が抑制され、それによって成長停止やMAPKの完全なリン酸化など、flg22に対する根の応答が可能になる。これらのデータと一致するように、IMAが欠損すると、根の表面に常在する常在菌のコロニー形成が抑制された。一方、IMA1過剰発現株は、葉面散布されたP. syringae pv. tomato DC3000に対してより抵抗性であった。今後、鉄の獲得と貯蔵の調節が、植物の根や芽におけるマイクロバイオームの構成や微生物の病原性にどの程度影響するかを調べることは興味深い。
以下原著論文の図1〜図6までの全文を訳しておくが、
紙面の制約ゆえに、図1,図2の一部、図5の一部のみを拡大転載しておいた。
図1|flg22は鉄欠乏時に鉄の取り込みを抑制する。
a, 地上部。スケールバー、cm。
b, Col-0のシュートの総クロロフィル濃度。
c, Col-0苗の鉄濃度。3生物学的複製。データは平均値±s.e.m.。統計解析は両側t検定を用いて行った。DW, 乾燥重量。
d,+Fe条件下で7日間生育させたCol-0根のFCR活性。d, +Fe, +Fe + flg22, -Fe または -Fe + flg22 液体培地に 2 日間移植した Col-0 の根の FCR 活性。5回の生物学的反復。 データは平均値±s.e.m.である。異なる文字は、一元配置分散分析(ANOVA)を用いて分析した異なる条件間の統計的に有意な差を示す。
e,+Feに反応したpIRT1::NLS-2xYpet苗の根におけるIRT1プロモーター活性。苗は+Fe 培地で生育させ、5日後に別の液体培地に移し、24時間処理した。DZは分化帯、EZは伸長帯、MZは分裂帯。緑は核局在Ypet、赤はヨウ化プロピジウム(PI)細胞壁染色。各処置について、代表的な単一共焦点切片(単一画像、GFP およびPI)、最大強度z投影(zmax、GFPのみ)、横方向視の単一光学切片およびz 横方向断面の光学的断面、および横方向断面のz-投影を示す。
f, pIRT1レポーターの生のシグナル強度の定量化。異なる文字は、一元配置分散分析を用いて分析した異なる条件間の統計的有意差を示す。一元配置分散分析(one-way ANOVA)とTukeyの検定(P < 0.05)を用いて分析した。
g, +Fe, -Fe + flg22, -Fe および -Fe + flg22 の条件下で生育させた Col-0 の根における IRT1 タンパク質レベルのウェスタンブロット分析。矢印はIRTタンパク質バンドを示す。 星印は非特異的なバンドを示す。チューブリン(TUB)タンパク質は内部コントロールである。
図2|flg22はIMA1を介して鉄欠乏応答を抑制する。
a, DEGsのRNA-seq解析。
b, よく知られた鉄応答性遺伝子(3つの独立した生物学的反復)の平均中心zスコア:鉄欠乏シグナル伝達成分、鉄取り込み成分、長距離シグナル伝達成分。
c-e,15日齢のCol-0とIMA1oxの苗において、低レベルのflg22処理(10 nM)の有無にかかわらず、鉄分充足(50 μM)または低鉄分(10 μM)条件に応答した表現型。
c, 新芽。d, 芽の総クロロフィル濃度 e, 苗の鉄濃度。dとeは3生物学的複製。データは平均値±s.e.m.である。P値は、両側スチューデントのt検定を用いて計算した。
f, Col-0およびIMA1oxの根におけるIRT1タンパク質レベルのウェスタンブロット分析(+Fe, +Fe + flg22, -Fe および -Fe + flg22処理に応答して)。
g, +Fe 条件下で 7 日間生育させ、+Fe, +Fe + flg22, -Fe および -Fe + flg22 液体培地に 2 日間移植した Col-0 および IMA1ox の根における FCR 活性の定量分析。5生物学的複製。データは平均値±s.e.m.である。異なる文字は、一元配置分散分析(one-way ANOVA)後にTukeyの検定(P < 0.05)を用いて分析した、異なる条件間の統計的に有意な差異を示す。
図3|flg22は根の地上組織でIMA1を空間的に抑制する。
a,b,pIMA1::eYFP-IMA1;ima8xの根におけるIMA1タンパク質レベル。内部コントロールはチューブリン。
a, +Fe, +Fe + flg22, -Fe, -Fe + flg22処理に対する反応。
b, 時間経過:苗を-Feで36時間前処理した後、-Feまたは-Fe+flg22(1μm flg22)で0、3、6時間処理した。
c, 根の分化領域における+Fe, +Fe + flg22, -Fe, -Fe + flg22処理に対するIMA1の分布。5日齢のIMA1::eYFP-IMA1;ima8x苗を+Fe培地で生育させた後、液体処理培地に24時間移した。黄色はeYFP-IMA1、赤色はPI細胞壁染色。各処理について、代表的な単一共焦点切片(単一画像、eYFP/PI)、zスタックの最大z投影(zmax、eYFPのみ)、横断面の単一光学切片、横断面のz投影を示す。スケールバーは50μm。
d, pIMA1::eYFP-IMA1;ima8xの根の分化領域におけるIMA1蛍光シグナル強度の定量化。統計解析は、両側Kruskal-Wallis検定に続き、両側Steel-Dwass-Critchlow-Fligner手順を用いた多重一対比較を用いて行った(P < 0.05)。
e,正規化シグナル径の定量法の模式図。
f, pIMA1::eYFP-IMA1;ima8x根の分化領域における異なる処理条件下での正規化IMA1シグナル径の定量。統計解析は、両側Kruskal-Wallis検定に続き、両側Steel-Dwass-Critchlow-Fligner手順を用いた多重一対比較を用いて行った(P < 0.05)。
g,h, IMA1発現を駆動する異なる組織特異的プロモーターを持つトランスジェニック植物の根におけるIRT1タンパク質レベルのウェスタンブロット分析。内部コントロールはチューブリンであった。
g, 低鉄によるIRT1の内因性誘導を避けるため、すべての苗を+鉄で生育させた。各トランスジェニック植物の3つの独立した系統を示す(Extended Data Fig.)
h, pPGP4::mCtirine-IMA1 の根を +Fe および および +Fe + flg22 での処理に対する pPGP4::mCtirine-IMA1 の根の反応。
図4|flg22はBTSL1およびBTSL2を介したIMA1分解によって鉄欠乏応答を抑制する。
a- c, +Fe(50μM)または-Fe(10μM)中、flg22(10nM)無処理または低濃度処理した15日齢の苗。
b- a, 地上部。スケールバーは1cm。
b, 地上部の総クロロフィル濃度。
c, 幼植物の鉄濃度。bとcは3生物学的複製。データは平均値±s.e.m.である。P値は両側スチューデントのt検定を用いて計算した。
d, +Fe 培地で 7 日間生育させ、+Fe, +Fe + flg22, -Fe および -Fe + flg22 液体培地に 2 日間移植した Col-0 および btsl1,2 の根における FCR 活性。5生物学的複製。
e, +Fe, +Fe + flg22, -Fe, -Fe + flg22処理群のCol-0およびbtsl1,2根におけるIRT1タンパク質レベルのウェスタンブロット解析。対照はチューブリンであった。
f, +Fe, +Fe + flg22, -Fe, -Fe + flg22処理に対するpBTSL1-GFPおよびpBSTL2-GFPの根分化帯の共焦点顕微鏡横断面。緑、GFPチャネル。スケールバー、50μm。
g, +Fe, +Fe + flg22, -Fe, -Fe + flg22処理群の根分化領域におけるIMA1の共焦点顕微鏡像。pIMA1::eYFP-IMA1;ima8xおよびpIMA1::eYFP-IMA1;btsl1,2の苗(5日齢)を+Fe培地で生育させた後、液体処理培地に24時間移植した。黄色はeYFP-IMA1、赤色はPI細胞壁染色。処理ごとに、代表的な共焦点切片(単一画像、eYFPとPI)、最大z投影(zmax、eYFPのみ)、横断面図の単一光学切片、横断面図のz投影を示す。スケールバーは50μm。
h,i, pIMA1::eYFP-IMA1;btsl1,2植物の根分化領域におけるIMA1蛍光シグナル強度(h)と正規化IMA1シグナル直径(i)を、+Fe、+Fe + flg22、-Feおよび-Fe + flg22処理群で比較した。pIMA1::eYFP-IMA1;ima8xは同時に撮影したため、図3e,fと同じデータセットを使用した。統計 統計解析は、両側Kruskal-Wallis検定に続き 両側Steel-Dwass-Critchlow-Fligner法を用いた(P < 0.05)。
図5|IMA1に依存した根圏酸性化は、根の免疫応答と細菌コロニー形成を制御する。
a,b, Col-0、ima8xおよびUBQ10::mCitrine-IMA1植物の+Feおよび-Fe処理後の根圏酸性化反応の画像化(a)および定量化(b)。pH指示薬としてブロモクレゾールパープルを用いた。
b, +Fe、+Fe+flg22、-Feおよび-Fe+flg22処理に対するCol-0、ima8xおよびUBQ10::mCitrine-IMA1植物による標準培地の酸性化。6生物学的反復。データは平均値±s.e.m.である。統計解析(各遺伝子型内)は、一元配置分散分析(one-way ANOVA)にTukeyの検定を加えて行った(P < 0.05)。両側Studentのt検定は、+Fe条件下でのCol-0とUBQ10::mCitrine-IMA1植物間の培地酸性化の統計的有意差を示すために用いた。
c,d、MES-KOH無添加(c)および1mM MES-KOH添加(d)の+Feおよび+Fe+flg22条件下でのCol-0、ima8xおよびUBQ10::mCitrine-IMA1植物の根の長さの定量。P値は、両側スチューデントのt検定を用いて計算した。
e, Col-0、ima8xおよびUBQ10::mCitrine-IMA1植物体のMES-KOHの有無によるflg22を介した根の成長応答の定量(+flg22/-flg22、+flg22の根の長さを-flg22の平均で割ったもの)。データは平均値±s.e.m.である。P値は両側スチューデントのt検定を用いて計算した。
f, +Fe および +Fe +flg22 群における CYP71A12 の転写レベルは、逆転写による qPCR(RT-qPCR)を用いて分析した。根を1μM flg22で1時間処理した。発現値はACT2で正規化した。3つの生物学的複製。データは平均値±s.e.m.である。統計解析は、一元配置分散分析(one-way ANOVA)およびTukeyの検定(P < 0.05)を用いて行った。
g, Col-0、ima8xおよびUBQ10::mCitrine-IMA1の根におけるflg22によるMAPKリン酸化のウェスタンブロット解析。根は1μM flg22で0、5、10分間処理した。内部コントロールはチューブリンであった。
h, 7日齢のシロイヌナズナの根を、+鉄、-鉄、および非利用可能鉄(nAvFe)条件下で、CHA0により接種1日後にコロニー形成させた。3生物学的複製。データは平均値±s.e.m.である。統計解析は、一元配置分散分析(one-way ANOVA)にTukeyの検定を加えて行った(P < 0.05)。
図6|IMA1の蓄積は、地表に棲息する細菌または侵入する細菌によって明瞭に調節される。
a, +Fe, +Fe + CHA0, -Fe, -Fe +CHA0, -Fe + flg22処理群におけるpIRT1::NLS-2xYpetの根。赤は細胞表面に局在するCHA0-mCherry菌、緑は核に局在するYpet。代表的な単一共焦点切片(単一画像、GFPとmCherry)、zスタックの最大z投影(zmax、GFPのみ)、および横断面の単一光学切片を示す。スケールバーは50μm。
b, +Fe, +Fe + CHA0, -Fe, -Fe + CHA0, -Fe + flg22処理群のpIRT1::NLS-2xYpet根における正規化シグナル定量。統計解析は、一元配置分散分析(one-way ANOVA)およびフィッシャー(Fisher)の最小有意差(LSD)検定(両側、P < 0.05)を用いて行った。
c, pIMA1::eYFP-IMA1;ima8x植物の根分化領域における+Fe, +Fe + CHA0, -Fe, -Fe + CHA0, -Fe + flg22処理群におけるIMA1の分布。赤は根の表面に局在するCHA0-mCherry菌、黄色はeYFP-IMA1(黄色チャンネル)。代表的な共焦点切片(単一画像、eYFPおよびmCherry)、zスタックの最大z投影(zmax、eYFPのみ)、および横断面の単一光学切片を示す。スケールバーは50μm。
d、+Fe、+Fe+CHA0、-Fe、-Fe+CHA0および-Fe+flg22処置群における正規化IMA1シグナル強度。統計解析は、一元配置分散分析(one-way ANOVA)とフィッシャーのLSD検定(両側、P < 0.05)を用いて行った。
e, +Fe, +Fe + CHA0, -Fe, -Fe + CHA0, -Fe + flg22処理群における表皮-皮質(epi-cortex)細胞層の正規化IMA1シグナル強度。統計解析は、一元配置分散分析(one-way ANOVA)とフィッシャーのLSD検定(両側、P < 0.05)を用いて行った。
f, +Fe, +Fe + CHA0, -Fe, -Fe + CHA0, -Fe + flg22投与群における正規化IMA1シグナル径の定量。統計解析は、一元配置分散分析(one-way ANOVA)とフィッシャーのLSD検定(両側、P < 0.05)を用いて行った。
g, +Fe, +Fe + CHA0, -Fe, -Fe + CHA0処理群における、側根原基におけるeYFP-IMA1の代表画像。赤色は内部に局在する CHA0-mCherry菌、黄色はeYFP-IMA1シグナル。星印は CHA0-mCherryは側根始原部位から根に侵入した。矢印は皮質における弱いIMA1シグナルを示す。スケールバーは50μm。単一 共焦点切片(単一画像、eYFPとmCherry)、zスタックの最大z投影(zmax z-スタックの最大z-投影(zmax、eYFPのみ)、および横方向視の単一光学切片を示す。BF、明視野。スケールバーは50μm。側根原基における+Fe、+Fe+CHA0、-Fe、-Fe+CHA0および-Fe+flg22処理群における正規化IMA1シグナル強度の定量化。統計解析は 統計解析は、一元配置分散分析(one-way ANOVA)とフィッシャーのLSD検定(両側、P < 0.05)を用いて行った。
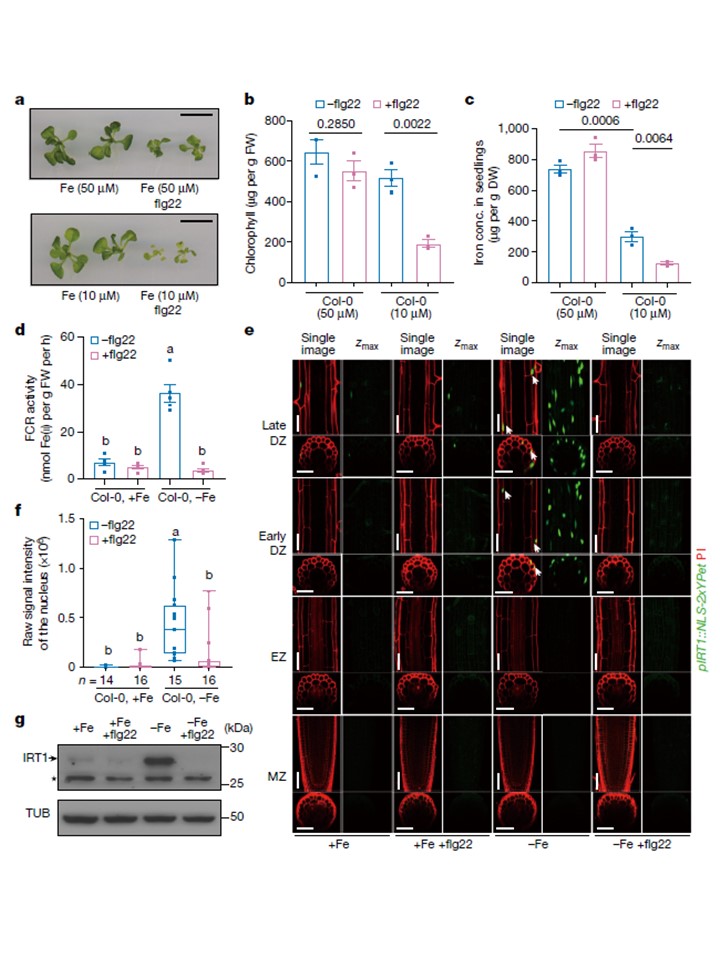
図1
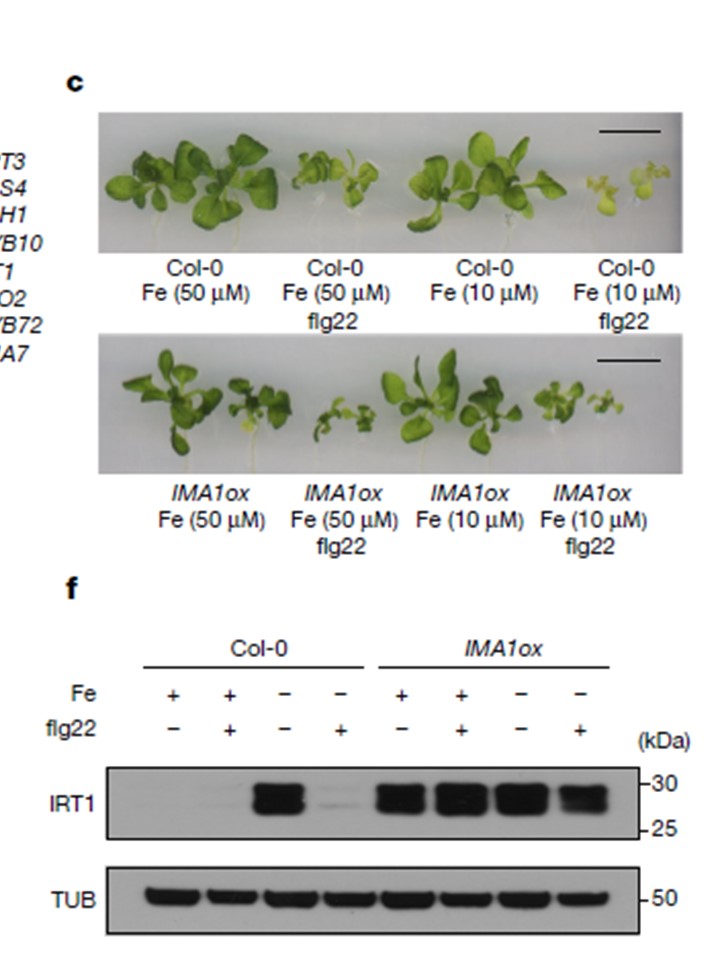
図2の一部の拡大
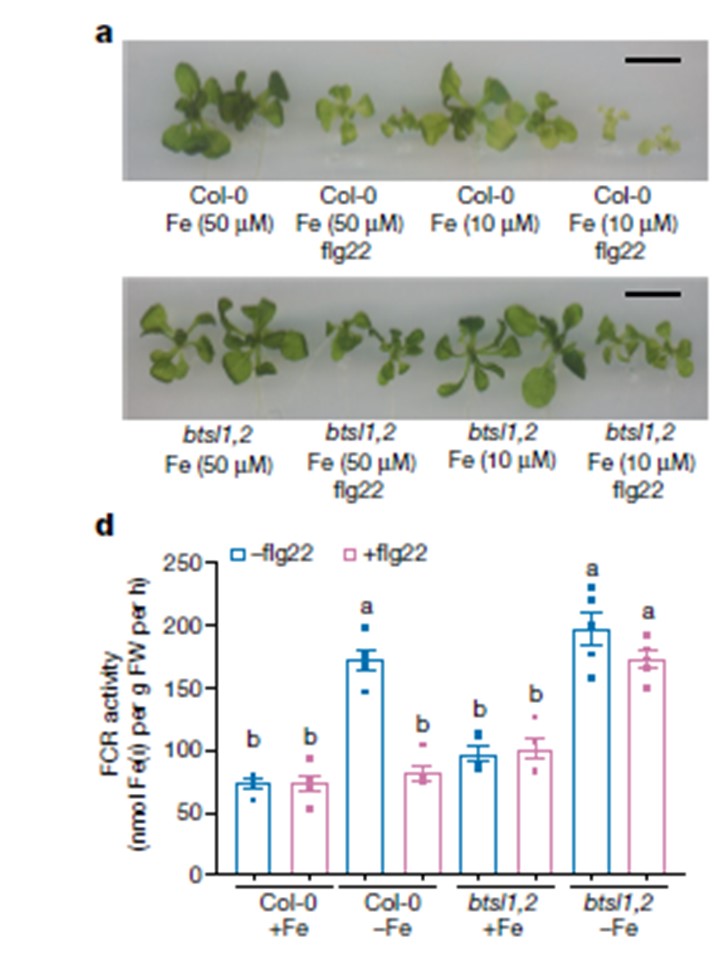
図4の一部の拡大