シロイヌナズナのStrategy-I型鉄獲得におけるクマリン依存性第二鉄還元反応の主要な役割
ドイツのNicoのグループは根が分泌するクマリン系代謝産物が、Strategy-I植物の鉄の吸収に関わっているという考えを持っている。この観点から、クマリン類が不溶態の3価鉄の可溶化に関わっているのか、2価鉄への還元に関わっているのかを、しつこく追及している。どうやらクマリン類-Fe(III)というキレート状態で、難溶性の3価鉄を可溶化して根の表面の3価鉄還元酵素に運んでいくという機能であるという結論を得ているようだ。これに対して古くからの日本の根圏有機物研究者はクマリン類をアレロパシーや抗菌性物質、休眠物質としてとらえていた。
本論文では8つの図があるのだが、ここでは紙面の関係で図1、図5、図7のみを転載した。しかし図の訳文では図1,2,3,4,5,6,7,8、すべてを訳しておいた。
シロイヌナズナのStrategy-I型鉄獲得におけるクマリン依存性第二鉄還元反応の主要な役割
Vanessa Paffrath ,1 Yudelsy A. Tandron Moya ,1 Gunther Weber ,2 Nicolaus von Wiren 1
and Ricardo F.H. Giehl 1,*
1 Leibniz Institute of Plant Genetics and Crop Plant Research (IPK) OT Gatersleben, Corrensstr 3, 06466 Seeland, Germany
2 Leibniz-Institut für Analytische Wissenschaften (ISAS) e.V., Bunsen-Kirchhoff-Str 11, 44139 Dortmund, Germany
THE PLANT CELL 2023: 1-23
要旨
非イネ科植物の多くは、鉄(Fe)欠乏に反応して様々なクマリンを放出する。しかし、これらのクマリンの生理学的意義はまだ十分に理解されていない。ここでは、シロイヌナズナの表皮および皮層細胞において、サイドレチン生合成につながる3つの酵素が共存していること、アルカリ性pHにおけるフラキセチンへの移行は、MYB72を介したCYTOCHROME P450, FAMILY 82, SUBFAMILY C, POLYPEPTIDE 4 (CYP82C4)の抑制に依存していることを示す。試験管内では、フラキセチンとサイドレチンだけが、それらが動員する鉄(III)の一部を還元することができる。フラキセチンとサイドレチンは、Fe(III)-キレート還元酵素変異体ferric reduction oxidase 2 ( fro2)を補完することができ、fro2植物におけるクマリン生合成の破壊は、Fe(II)取り込み欠損変異体iron-regulated transporter 1 (irt1)と同様にFeの取り込みを障害することから、クマリンを介したFe(III)還元は酸性条件下で重要であることが示された。また、fro2 cyp82C4-1二重変異体におけるサイドレチン生合成の阻害により、サイドレチンがFRO2とともに根からの鉄(II)吸収のための鉄(II)形成を仲介する化学的還元物質として機能することが明らかになった。アルカリ性pHでは、クマリン類によるFe(III)の還元はほとんど無視できる程度になるが、フラキセチンは依然として高いFe(III)動員を維持していることから、その主な機能はFRO2にキレートFe(III)を供給することであることが示唆された。このことから、ストラテジーI植物は、サイドレチンとフラキセチンの生合成と分泌を外部pHと連動させ、土壌pH条件に応じてクマリンの化学的活性を変化させ、鉄の吸収を最大化させていることが示唆された。
概要(著者による囲み記事)
背景: 鉄(Fe)は地殻中に豊富に存在するが、pHが弱酸性からアルカリ性の条件下では、植物に対するこの微量栄養素の利用率が低下する。シロイヌナズナのような非イネ科植物は、取り込みの前にFe(III)の還元を必要とする "戦略I "Fe獲得メカニズムに依存している。FERRIC REDUCTION OXIDASE2 (FRO2)のようなFe(III)還元酵素活性はpHに敏感であるため、これらの植物は一般的に高pHによる鉄欠乏を起こしやすい。還元に基づく戦略を採用する種の鉄獲得は、フェニルプロパノイド経路由来の二次代謝産物であるクマリンの放出によってサポートされることが多い。
疑問: 鉄欠乏性シロイヌナズナから分泌される酸化還元活性クマリンは、根における鉄還元に寄与しているのか?もしそうなら、この機能はFRO2とどのように関連しているのか?クマリンの組成とそれぞれのクマリンの化学活性は、環境pHによってどのように調節されるのか?
発見: fro2変異体におけるクマリン生合成経路の単一ステップを破壊することにより、クマリンが鉄(III)還元において生理的に重要な役割を果たしていることを明らかにした。シロイヌナズナではサイドレチンが支配的な化学還元物質であり、FRO2とともに、酸性条件下で根に取り込まれる鉄(II)の生成に寄与していることを明らかにした。アルカリ性pHでは、転写因子MYB72がクマリン生合成をサイドレチンからフラキセチンへとシフトさせる。このような条件下では、フラキセチンの主な機能は、鉄還元ではなく、可溶性鉄(III)基質をFRO2に提供することである。
次のステップ: クマリンを介した鉄還元に遺伝的変異があるかどうか、また、クマリン組成のpH依存的調節におけるMYB72の推定される役割を明らかにするために、今後の研究が必要である。
さらに、クマリンを介した鉄(III)還元が根の微生物相に影響を与えるかどうか、またどのように影響を与えるかを調べることも興味深い。
図1.
鉄非存在下、異なる外部pHおよび緩衝液条件にさらされた根におけるF6′H1、S8HおよびCYP82C4のpH依存的存在量と組織特異的局在。
A) 簡略化されたクマリン生合成経路。F6′H1は、フェニルプロパノイド経路から誘導されたフェルロイル-CoAを6′-ヒドロキシフェルロイル-CoAに変換し、このフェルロイル-CoAは、部分的に自発的に、またCOSYの活性によってスコポレチンに変換される。S8HとCYP82C4は、それぞれカテコール性クマリンであるフラキセチンとサイドレチンを生成する。簡単のため、これらの分子のアグリコンだけが描かれている。
BとC) プロF6′H1:F6′H1-GFP、プロS8H:S8H-GFP、およびプロCYP82C4:F6′H1-GFPの根毛帯で検出されたGFPおよびヨウ化プロピジウム(PI)シグナル。proCYP82C4:CYP82C4-GFP翻訳融合系統で検出された。植物は、pH5.6で40μMのFe-EDTAを添加した半強度ムラシゲ・スクーグ(MS)培地で10日間前培養した後、Feを添加せず、MESでpH5.6またはpH6.5、またはMOPSでpH7.5に緩衝化した半強度MS培地に移植した。画像は指示された条件下への移植から4日後に撮影した。Zスタックから再構成した横断面(B)と、表皮細胞、皮質細胞、内胚葉細胞におけるシグナルの定量化(C)を示す。箱ひげ図は第1四分位数、中央値、第3四分位数を示す。ひげは最小値と最大値まで伸びている(CYP82C4-GFPについてはn = 8個の独立した根、F6′H1-GFPとS8H-GFPについてはn = 9個の独立した根)。異なる文字は有意差(P < 0.05)を示し、順位に関する一元配置分散分析(ANOVA)と事後Student-Newman-Keuls検定に従った。スケールバーは50μm。根の組織層はep: 表皮、co: 皮質、en: 内皮と表示した。PIはヨウ化プロピジウム。
D) F6′H1-GFP、S8H-GFPおよびCYP82C4-GFPの細胞内局在。画像は、鉄を添加せず、MESで緩衝化した半強度MS培地に移植して4日後に撮影した。
MESでpH5.6(CYP82C4-GFP)またはpH6.5(F6′H1-GFPおよびS8H-GFP)に緩衝した。スケールバー、20μm。
図2.
根および滲出液中のクマリン濃度に及ぼす鉄、外的pHおよびクマリン輸出の影響。A) 異なる鉄制限条件および外部pHで4日間生育させたA. thaliana (Col-0)植物における個々のクマリン種の分泌速度。根滲出液は、それぞれのpHに調整したMES-またはMOPS-緩衝水中で6時間収集した。シデレチンは酸化型と還元型の合計を表す。バーは 平均値±SD(各140株から集めた滲出液のプールからなるn=4〜5生物学的複製)。B) 根抽出物中のフラキシン濃度 野生型(Col-0)、s8h-2、cyp82C4-1およびpdr9-2植物を、20μM FeCl3 培地で4日間生育させた。棒グラフは平均値±SDを表す(n = 140株の根をプールした中からの4〜5回の繰り返し実験)。
C) 野生型(Col-0)およびpdr9-2植物の根抽出物中の、示されたクマリン対の脱グリコシル化形態の割合。棒グラフは平均値±SDを表す(各々140株から集めた滲出液のプールからなるn = 4から5のl繰り返し実験)。Sco、スコポリン/スコポレチン対;Fra、フラキシン/フラキセチン対。FWは新鮮重;n.d.は検出されなかった。AからCでは、植物をpH5.6で40μMのFe-EDTAを添加した半強度MS培地で10日間前培養した後、MESでpH5.6またはpH6.5、またはMOPSでpH7.5に緩衝した20μMのFeCl3(FeCl3)、またはFeを添加せず15μMのフェロジン(Feなし)を添加した半強度MS培地に移した。異なる文字は、全グループ間(AおよびB)または各代謝物グループ内(C)での有意差(P < 0.05)を示し、一元配置分散分析(one-way ANOVA with post hoc Tukey's test)(スコポリンおよび(C)のデータ)または一元配置分散分析(one-way ANOVA on ranks with post hoc Student-Newman-Keuls test)(他のすべての比較)による。n.s.、一元配置分散分析によると有意ではない(P > 0.05)。
図3.
アルカリ性条件によるCYP82C4発現阻害はmyb72-1変異体では減弱している。A) pH依存的なMYB72およびFIT 植物は、Murashige とSkoog(MS)培地で10日間前培養した後、80μM FeEDDHA、20μM FeCl3(FeCl3)を添加したMS培地に移植した。またはFe無添加+15μMフェロジン(Fe無添加)、MESでpH5.6またはpH6.5、MOPSでpH7.5に緩衝化した。相対転写レベルはUBQ10とACT2 UBQ10とACT2で正規化した。棒グラフは平均値±SDを表す(n = 12株の根をプールした回試行)。EDDHA、 エチレンジアミン-N,N′-ビス(2-ヒドロキシフェニル)酢酸。B)Col-0およびmyb72-1植物におけるF6′H1、S8H、CYP82C4およびPDR9の相対発現。植物は、pH5.6で40μMのFe-EDTAを添加した半強度MS培地で10日間前培養し、次いで20μMのFeCl3(EDTA)を添加した半強度MS培地 MESでpH5.6またはpH6.5に、あるいはMOPSでpH7.5に緩衝化した20μM FeCl3 (FeCl3)を添加した半強度MS培地に移植した。伝子発現をRT-qPCRで評価した。相対転写レベルはUBQ10とACT2で正規化した。棒グラフは平均値±SDを表す。各12株の根をプールした生物学的複製。) AおよびBにおいて、異なる文字は一元配置分散分析による有意差(P < 0.05)を示す。一元配置分散分析(Tukey's検定後)(FIT、S8H、CYP82C4、PDR9)、または一元配置分散分析(Student-Newman-Keuls検定後 (MYB72およびF6′H1)。
図4.
異なる外部pH条件下で、不溶性鉄源から鉄を動員・還元する各種クマリンの能力。 等モル量のEDTA、アスコルビン酸(Asc)、スコポレチン(Sco)、エスクレチン(Esc)、フラキセチン(Fra)、サイドレチン(Sid)、または溶媒MeOHによるin vitroでの鉄(III)動員および還元。化合物は、pH5.6(A)、pH6.5(B)、またはpH7.5(C)で、沈殿したばかりの鉄(FeCl3として供給)と一緒に暗所でインキュベートした。反応開始から10分後、30分後、1時間後、3時間後、6時間後、24時間後にアリコートを採取した。総動員鉄量はICP-MSで測定し、Fe(II)-フェロジン錯体の形成に基づいて、還元Fe量を分光光度法で評価した。y軸の上端は、実験で使用したFeの総量を表す。バーは平均値±SD (n = 3 反応を独立に行った)。
図5.
異なるクマリン類によるfro2の鉄欠乏の緩和。A〜E)異なるクマリンを添加した固体寒天培地で6日間培養した野生型(Col-gl1)およびfro2植物の植物外観(AおよびC)、シュートのクロロフィル濃度(BおよびD)、およびシュートのFe含量(E)。40μMのFe-EDTAを添加したpH5.6の半強度MS培地で前培養した10日齢の苗を、MESでpH5.6(AおよびB)またはpH6.5(CおよびD)に緩衝した20μMのFeCl3を添加した半強度MS培地に移植した。培地にはスコポレチン(Sco)、エスクレチン(Esc)、フラキセチン(Fra)、サイドレチン(Sid)、または溶媒(mock)のみを添加した。スケールバーは5mm。BとDでは、バーは平均値±SDを表す(n = 4から6の生物学的複製で、それぞれ4つのプールされたシュートで構成される)。Eでは、バーは平均値±SDを表す(n = 3生物学的複製、各4シュート)。B、D、Eにおいて、各pH条件内の異なる文字は、一元配置分散分析(one-way ANOVA)とTukeyのポストホック検定による有意差(P < 0.05)を示す。FWは新鮮重量。FおよびG)fro2とcyp82C4-1の共培養は、低pHにおける葉のクロロシスを緩和した。実験(F)およびfro2とf6′h1-1またはcyp82C4-1を共培養した植物のシュート外観(G)の模式図。植物は、pH5.6で40μMのFe-EDTAを添加した半強度MS培地で10日間前培養した後、MESでpH5.6またはpH6.5に緩衝した20μMのFeCl3を添加した半強度MS培地に移し、さらに11日間培養した。矢印はfro2の若葉の再緑化を示す。スケールバーは0.5cm。
図6.
fro2植物における根のクマリン濃度とクマリン滲出速度の調節。A) 鉄を添加せず、15μMのフェロジンを加え、MESでpH5.6またはpH6.5に緩衝したMS固形培地で4日間生育させた野生型(Col-gl1)とfro2植物の根におけるF6′H1、S8H、CYP82C4、PDR9の相対発現。
相対転写レベルはUBQ10とACT2で正規化した。棒グラフは平均値±SDを表す(n = 12株の根をプールした4生物学的複製)。B-D)グリコシル化(glyc.)および脱グリコシル化(deglyc.)クマリンの総滲出速度(B)、ならびにpH5.6(C)およびpH6.5(D)における個々のクマリンの滲出速度。40μMのFe-EDTAを添加したpH5.6の半強度MS培地で前培養した10日齢の野生型(Col-gl1)およびfro2苗を、15μMのフェロジンを添加したFe無添加の半強度MS培地に移植し、MESでpH5.6またはpH6.5に緩衝化してさらに4日間培養した。n.d.は検出されなかった;FWは新鮮重。A、C、Dでは、有意差(P < 0.05)をStudent's t-testによる星印で示した(*P < 0.05, **P < 0.01, ***P < 0.001)。
図7.
FRO2とF6′H1の同時破壊は、重度の鉄欠乏と鉄蓄積の減少をもたらす。A から C) fro2 f6′h1-1 二重変異体の表現型解析。野生型(Col-0 x Col-gl1)、fro2、f6′h1-1、fro2 f6′h1-1二重変異体、およびirt1-1植物の外観(A)、シュート新鮮バイオマス(B)、および葉クロロフィル濃度(C)は、非石灰化基質上、またはFe(III)-EDDHAを週3回補充した(土壌施用)20g炭酸カルシウム植物で制限した基質上で19日間生育させた。棒グラフは平均値±SD(n=4〜8個の新芽からなる6〜7個の生物学的複製)を表し、各条件内の異なる文字は、一元配置分散分析(一元配置分散分析)とポストホックTukey検定(非限定)、または一元配置分散分析(順位)とポストホックDunn検定(限定)に従った有意差(P < 0.05)を表す。FWは新鮮重。スケールバーは2cm。D) 合成Fe-キレートFe(III)-EDDHAを添加した(FeEDDHA)、または添加しなかった(コントロール)非限定基質(pH〜5.5)上で19日間生育させた後の標記遺伝子型のシュートFe含量の比較。棒グラフは平均値±SD(n=4〜5生物学的複製、各4〜8個の新芽をプールしたもの)を表し、異なる文字は、順位の一元配置分散分析(post hoc Student-Newman-Keuls検定による)による有意差(P < 0.05)を表す。EDDHA、エチレンジアミン-N,N′-ビス(2-ヒドロキシフェニル)酢酸。E)寒天平板上で、異なる低Fe利用率条件下で6日間培養した野生型(Col-0 x Col-gl1)、fro2、f6′h1-1、fro2 f6′h1-1二重変異体、およびirt1-1植物の外観。40μMのFe-EDTAを添加したpH5.6の半強度MS培地で前培養した10日齢の苗を、MESでpH5.6またはpH6.5に緩衝した20μMのFeCl3を添加した半強度MS培地、またはMOPSでpH7.5に緩衝した半強度MS培地に移植した。シュートのバイオマス、クロロフィル濃度、鉄の濃度と含有量の定量を補足図S14に示す。スケールバーは0.5cm。F〜G)膜結合型第二鉄還元酵素と化学還元剤による複合鉄(II)生成能(F)、および第二鉄を非キレート型(FeCl3)またはキレート型(Fe(III)-EDTA)として微酸性またはアルカリ性条件下で供給した場合の、標記遺伝子型の記録された鉄(II)生成能(G)を測定するために使用した手順を示す概略図。アッセイでは、鉄欠乏植物の根を、指示された鉄源を含み、MES(pH 5.5)で緩衝した溶液に入れた。棒グラフは平均値±SD(n = 6株ずつ、5〜6個の独立した複製)を表し、各鉄源について異なる文字 各鉄源について異なる文字は、一元配置分散分析(one-way ANOVA)とTukeyのポストホック検定による有意差(P < 0.05)を表す。
図8.
カテコール性クマリンによる非酵素的な鉄(III)還元の重要な役割、酸性条件下ではサイドレチンが支配的な役割を果たす。A〜C) わずかに酸性の土壌基質におけるfro2 s8h-1およびfro2 cyp82C4-1二重変異体の特性。植物外観(A)、葉クロロフィル濃度(B)、およびシュート鉄含有量(C)は、合成鉄キレート鉄(III)-EDDHAを週3回添加した、または添加しない非限定基質(pH〜5.6)上で19日間生育した後の遺伝子型を示した。棒グラフは平均値±SDを表す(n = 5生物学的複製、各5本の新芽をプール)。各遺伝子型グループ内の異なる文字は、一元配置分散分析(one-way ANOVA with post hoc Tukey's test (B))または一元配置分散分析(one-way ANOVA on ranks with post hoc Student-Newman-Keuls test (C))による有意差(P < 0.05)を表す。スケールバーは2cm。FWは新鮮重;EDDHAはエチレンジアミン-N,N′-ビス(2-ヒドロキシフェニル)酢酸。DおよびE)fro2 cyp82C4-1植物はfro2 f6′h1-1よりも外部pH上昇に耐性がある。異なる外部pH条件下で6日間培養した後の、示した遺伝子型の植物外観(D)とクロロフィル濃度(E)。40μMのFe-EDTAを添加したpH5.6の半強度MS培地で前培養した10日齢の苗を、MESでpH5.6またはpH6.5に、またはMOPSでpH7.5に緩衝した20μMのFeCl3を添加した半強度MS培地に移植した。棒グラフは平均値±SD(n = 4から5個の生物学的複製、各4個のシュートで構成)を表し、各pH条件内の異なる文字は、一元配置分散分析(one-way ANOVA)およびポストホックTukey検定による有意差(P < 0.05)を示す。による有意差(P < 0.05)を示す。スケールバーは0.5cm。FWは新鮮重。F) 鉄欠乏培地(鉄無添加+15μg)で4日間生育させた後の遺伝子型の鉄(II)生成能。Fe欠乏培地(Fe無添加+15μMフェロジン、MESで緩衝したpH6.5)上で4日間生育させた後の遺伝子型のFe(II)生成能。アッセイでは、無傷の植物の根を、pH 6.5 で緩衝化した FeCl3 を含む溶液に6時間置いた。棒グラフは平均値±SD(n = 6株ずつ4生物学的反復)を表し、異なる文字は有意差(P < 0.05)を表す。異なる文字は、一元配置分散分析(one-way ANOVA)とTukeyのポストホック検定による有意差(P < 0.05)を表す。FWは新鮮重。
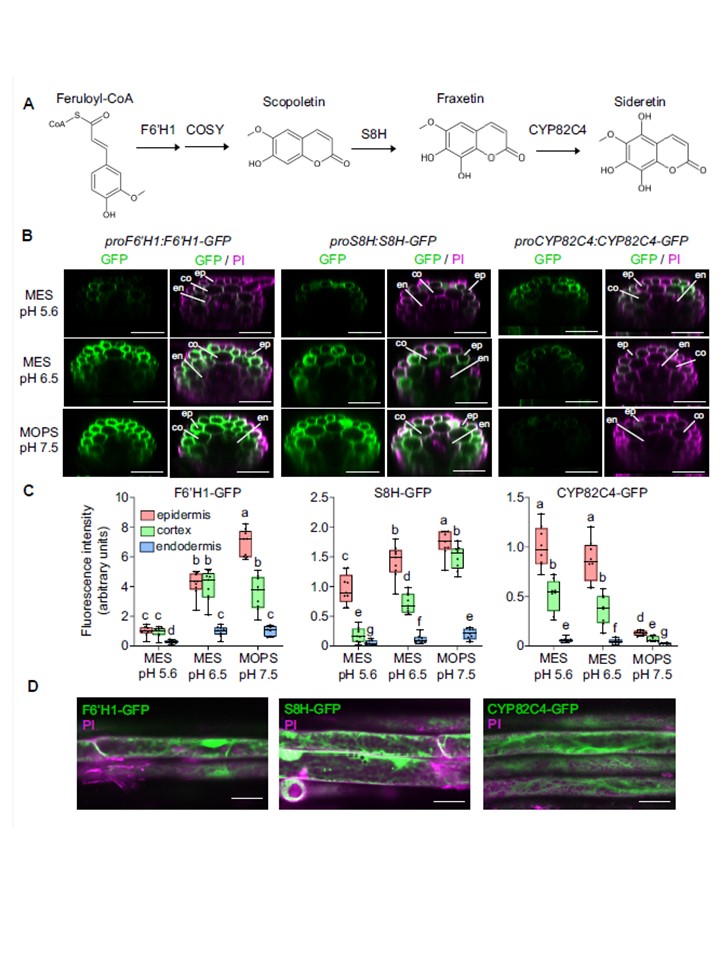
図1
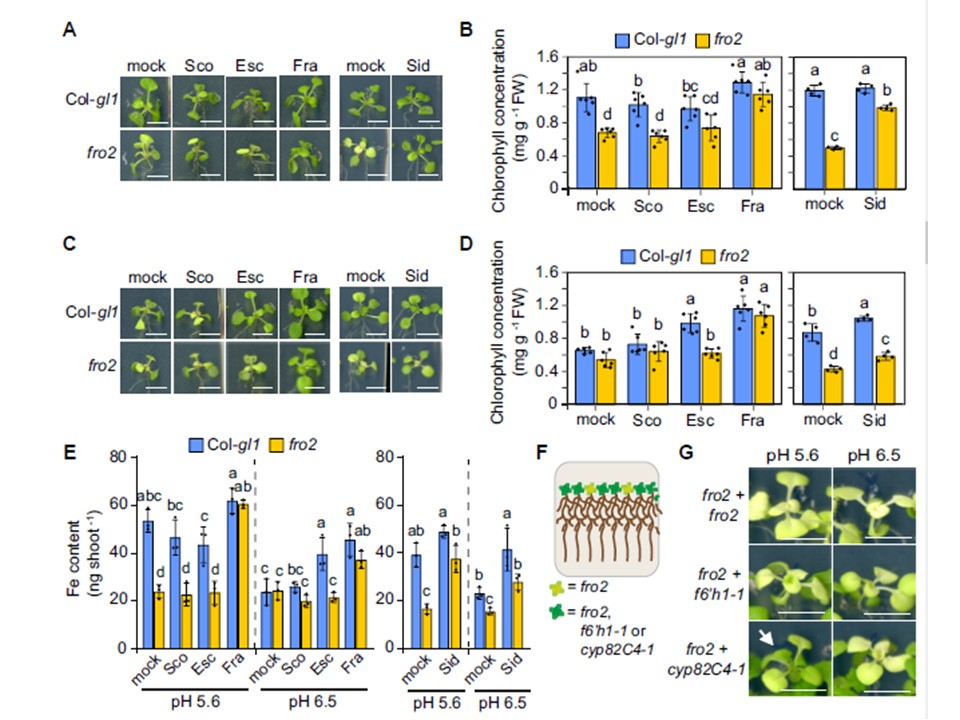
図5
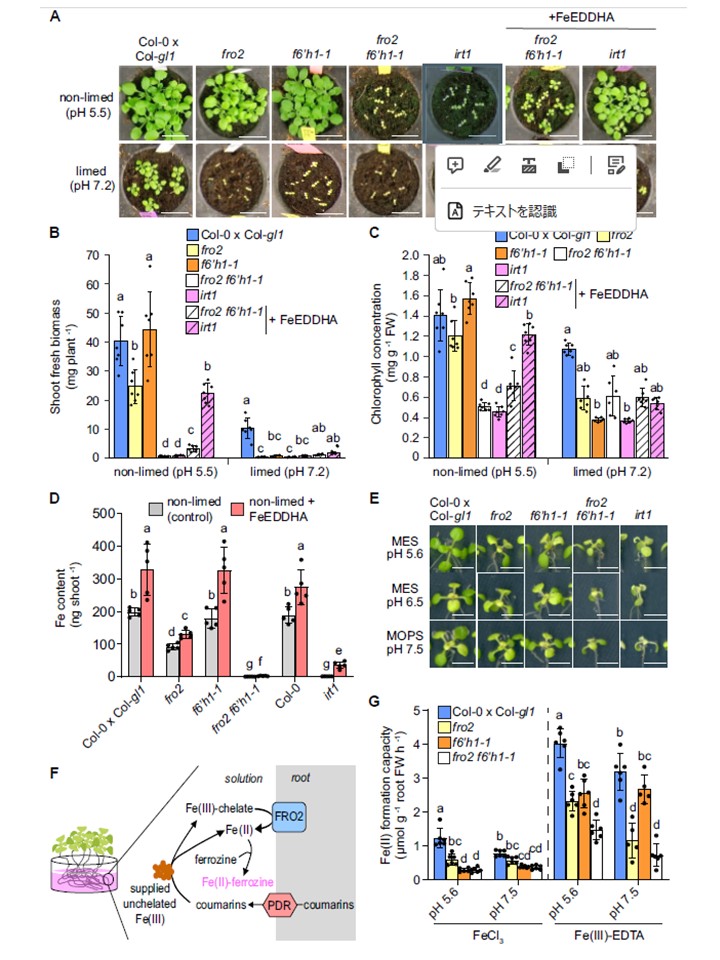
図7