鉄過剰蓄積シロイヌナズナの遺伝子型解析から、全身性シグナル伝達および逆行性シグナル伝達の新規調節因子が明らかになった
台湾のWolfgang Schmidtのグループが気を吐いている。鉄に関する新しい調節因子を見つけたようだ。
鉄過剰蓄積シロイヌナズナの遺伝子型解析から、全身性シグナル伝達および逆行性シグナル伝達の新規調節因子が明らかになった
Transcriptome analysis of iron over-accumulating Arabidopsis
genotypes uncover putative novel regulators of systemic and
retrograde signaling
Louis Grillet, En-Jung Hsieh, Wolfgang Schmidt
1Department of Agricultural Chemistry, College of Agriculture and Bioresources, National Taiwan University, Taipei, Taiwan
2Institute of Plant and Microbial Biology, Academia Sinica, Taipei, Taiwan
3Biotechnology Center, National Chung-Hsing University, Taichung, Taiwan
4Genome and Systems Biology Degree Program, College of Life Science, National Taiwan University, Taipei, Taiwan
Plant Genome. 2023;e20411. https://doi.org/10.1002/tpg2.20411
本論文を読むにあたっての略号
Abbreviations: ACO, aconitase; bHLH, basic helix-loop-helix transcription factor; BTS, BRUTUS; CCS, chaperone for superoxide dismutase; CSD, copper superoxide dismutase; CYP, cytochrome; DEG, differentially expressed gene; DGAT, diacylglycerol acetyl transferase; DNA, deoxyribonucleic acid; ES, Estelle and Somerville growth medium; EYFP, enhanced yellow fluorescent protein; FC, fold change; FER, ferritin; Ferrozine,
3-(2-pyridyl)−5,6-diphenyl-1,2,4-triazine sulfonate; FRO, ferric reductase oxidase; FSD, Fe superoxide dismutase; GSTL, glutathione S-transferase lambda;
IMA, IRONMAN; IRP, iron regulatory protein; IRT1, iron regulated transporter; NA, nicotianamine; NAS, nicotianamine synthase; OPT, oligopeptide transporter; ORF, open reading frame; Ox, overexpressor; PCR, polymerase chain reaction; RNA, ribonucleic acid; RNS, S-like RNAse; RPKM, reads per million kilobase; rRNA, ribosomal RNA; RT-qPCR, real-time quantitative polymerase chain reaction; S8H, scopoletin 8-hydroxylase; SOD, superoxide dismutase; SPL, squamosa-promoter binding-like protein; T-DNA, transfer DNA; tRNA, transfer ribonucleic acid; UTR, untranslated region; YSL, yellow stripe1-like; ZIP, zinc/iron permease.
論文要旨
鉄(Fe)は、電子を受容したり供与したりする能力を持つことから、植物を含むあらゆる生命体にとって不可欠な元素である。鉄のホメオスタシスを維持するには、プラスチドのような鉄シンクの需要を満たすために、鉄の取り込み、輸送、移動を正確に制御する必要がある。全身の鉄輸送体OPT3(OLIGOPEPTIDE TRANSPORTER 3)に欠損を持つ植物は、構成的な鉄欠乏反応を示し、葉に有毒レベルの鉄を蓄積する。同様に、葉茎に局在するシグナルペプチドファミリーをコードするIRONMAN(IMA)遺伝子の異所性発現は、推定鉄センサーであるBRUTUSを阻害することにより、鉄の取り込みと蓄積を引き起こす。本研究では、OPT3を介した全身の鉄輸送、葉茎におけるIMA遺伝子の活性化、根表皮における鉄取り込みの活性化の間に働くメカニズムを解明することを目的とした。opt3-2変異株とIMA1/IMA3過剰発現株(IMA Ox)の転写プロファイリングから、3つの遺伝子型すべてと鉄欠乏対照植物で一貫して異なる発現を示し、細胞内鉄ホメオスタシスの潜在的な新規制御因子を構成する遺伝子群を発見した。特に、F-boxタンパク質At1g73120の発現は、すべての遺伝子型において強固に誘導され、細胞内鉄ホメオスタシスの翻訳後制御における推定機能を示唆した。このモジュールのさらなる構成要素として、転移リボ核酸(tRNA)由来の小リボ核酸を産生すると推定される2つのプラスチドにコードされる遺伝子座は、根の鉄吸収の逆行性制御に関与している可能性がある。このモジュールのさらなる構成要素として、トランスファーリボ核酸(tRNA)由来の小リボ核酸を産生すると推定されるプラスチドにコードされた2つの遺伝子座が、根のFe取り込みの逆行性制御に関与している可能性がある。
はじめに
鉄(Fe)は地殻中に4番目に多く存在する元素である。鉄(Fe)は地殻中で4番目に豊富な元素であり、土壌物質の1〜5%を占めるが、鉄欠乏は植物における最も広範な栄養ストレスのひとつである (Hansen et al., 2004)。したがって、鉄の生物学的利用能と、鉄を可 溶化し取り込むメカニズムが、鉄がほとんど生物学的に利用されな い石灰質土壌における作物の鉄の状態や収量を決定する(Marschner、
1995). 育種や遺伝子組換えアプローチによる鉄取り込みの強化は、アルカリ性条件下での植物の性能と適性を改善することが示された(Gautamら、2021;Kobayashiら、2022;Moran Lauterら、2014)。したがって、鉄を過剰に蓄積する遺伝子型を理解することは、収量と栄養価を向上させる作物を工学的に作出するための新たな分子標的を発見する有望な方法である。
植物は、生化学的・進化的に異なる2つの鉄獲得戦略を進化させてきた。 還元に基づく戦略(非イネ科種)と、イネ科植物が採用するキレートに基づく戦略(Strategy II; Ve Strategy II; Velez-Bermudez & Schmidt, 2023)。
この鉄獲得のメカニズムの系統学的区別はほとんどの点で有効であるが、2つの戦略の相互排他性については疑問視されている(Grillet & Schmidt, 2019)。
最近、イネ科以外の種も鉄固定化キレーター分子を分泌できることが明らかになったが、イネ科の種が分泌するムギネ酸由来のヒトシデロフォアとは化学的に異なる(Robe et al.., 2021; Tsai & Schmidt, 2017))これまでに研究されたすべての被子植物に共通して、鉄の獲得に関与するタンパク質をコードする遺伝子が転写される。
鉄の獲得に関与するタンパク質をコードする遺伝子は、転写因子(bHLH)ファミリーのメンバーを中心とする複雑な転写因子カスケードによって制御されている(Gao & Dubos, 2020; Kobayashi, 2019)。
Strategy IとStrategy IIの植物には生理学的な違いがあるにもかかわらず、転写反応のアーキテクチャーは驚くほど類似している。Grillet&Schmidt, 2019)。最も最近発見された共通の制御機構は、IRONMAN(IMA)と呼ばれるペプチドファミリーからなるペプチドファミリーである。植物が鉄欠乏にさらされると、遺伝子によってコードされるIRONMAN(IMA)と呼ばれるペプチドファミリーが迅速かつ強固に発現上昇する(Grillet et al;Kobayashi et al., 2020)。IMAペプチドはシロイヌナズナの転写的鉄欠乏応答に重要であり、鉄欠乏植物における鉄の取り込みを活性化することができる。IMAレベルが上昇すると、植物のあらゆる部分に鉄とマンガン(Mn)が大量に蓄積し、葉が壊死し、最終的には植物が枯死する。
ヒトでは、鉄のホメオスタシスを維持する重要なメカニズ
を維持し、IRP1やIRP2といった鉄調節タンパク質(IRP)の翻訳後制御を通じて、全身の鉄バランスに寄与している(Moroishi et al.2011; Wang & Pantopoulos, 2011)。IRP1は月光タンパク質である。鉄が過剰な条件下では、IRP1は細胞質アコニターゼ(ACO)として働き、クエン酸からイソクエン酸への変換を触媒する。鉄欠乏条件下では、IRP1はこの触媒能力を失い、標的転写産物の非翻訳領域(UTR)に位置する鉄応答性エレメント(IRE)に結合することで、主要な鉄取り込み遺伝子を転写後制御するリボ核酸(RNA)結合タンパク質に変化する(Rouault, 2006)。IRP2もIRE結合タンパク質である。
IRP2の活性は、ユビキチン化とプロテアソーム分解を通じて、F-boxタンパク質FBXL5(Ruiz et al.2013) によって制御されている。
FBXL5はヘメリトリンモチーフを持ち、鉄との結合によりF-ボックス機能を活性化し、SKP1 Cullin F-box(SCF)E3ユビキチンリガーゼ複合体によるIRP2のユビキチン化の標的化を引き起こす(Takahashi-Makise et al.)
トランスフェリン受容体と鉄貯蔵タンパク質であるフェリチン(FER)の転写後制御は、IRPによるものであり、ヒトにおける鉄感受性の中核をなすと考えられている。
植物では、BRUTUS (BTS)およびBRUTUS様(BTSL)タンパク質は、結合して鉄取り込みに対する負のフィードバック制御を伝えるヘムエリスリンモチーフを有する推定E3ユビキチンリガーゼである(Hindt et al., 2017; Long et al., 2010; Rodríguez-Celma et al., 2019; Selote et al., 2015).
IMAペプチドは IMAペプチドは、そのC末端を介してBTSおよびBTSLと相互作用することにより、鉄の取り込みを制御する。C末端を通してBTSおよびBTSLと相互作用することにより、鉄の取り込みを制御し、それによってbHLH105 とbHLH115の分解を阻害することにより、鉄欠乏誘導遺伝子のポジティブレギュレーターである 遺伝子の分解を防いでいる(Liら、2021年)。
IMA1とIMA3は、BTS/BTSLに対するそれぞれの親和性によって決定される、異なる生物学的機能を持つことが示唆された(Rodríguez-Celma et al、 2019). 実際、IMA1はBTSLと優先的に相互作用し 、鉄の取り込みを制御している可能性が高い(Okada et al.)
しかし、IMAが主に葉茎に局在することは、これらのモデルと矛盾する。これまでのところ、植物において鉄ホメオスタシスの制御に関与するF-boxタンパク質は同定されていないマルス・ドメスティカ(Zhao et al.). これらの鉄感知機構では、ヘムエリスリンドメイン は鉄に対して選択的であるため、反応の特異性にとって重要である。
Feと、銅(Cu)のようなFeと化学的類似性を共有する他の金属を区別することは、Feの取り込みと輸送を増加させる一方で、他の元素の毒性レベルの蓄積を避けるために重要である。
CuとFeはともに、Pisum sativumではアポ可塑性コンパートメントでニコチアナミン(NA)によってキレートされ(Frisら、2016)、Arabidopsis thalianaではイエローストライプ1様(YSL)タンパク質(Le Jeanら、2005;Watersら、2006)によって植物全体に輸送される。
さらに最近、硝酸塩トランスポーターとペプチドトランスポーターファミリーのトランスポーターがNAの小胞輸送を仲介し、シロイヌナズナのアポプラスティックとシンプラスティックコンパートメント間の鉄と銅の循環を促進することが報告された(Chao et al.)
銅と鉄のシグナリングのクロストークについてはよく論じられている。銅トランスポーターの異所性発現は、鉄の輸送とホメオスタシスに影響を与えるようである(Perea-García et al.)
転写因子squamosa-promoter binding-like protein7(SPL7)は、銅欠乏応答の中心的な制御因子である(Yamasaki et al.) 銅欠乏にさらされると、SPL7の発現が低下した変異体は、CSD1とCSD2(CSDは銅スーパーオキシドジスムターゼ、そのシャペロンであるCu CCS(スーパーオキシドジスムターゼのシャペロン)、そして特にFe制御ペプチドIMA2を抑制できない。SPL7は、CSD1、CSD2、CCS mRNAの転写後阻害因子として働くマイクロRNA miR398前駆体miR398BとmiR398Cのアップレギュレーションを仲介する(Sunkarら、2006;Yamasakiら、2007)。対照的に、YSL2、ZIP2(ZIPは亜鉛/鉄パーミアーゼとCOPT2トランスポーター)、FRO4やFRO5などの鉄還元酵素オキシダーゼ(FRO)、FSD1などの鉄スーパーオキシドジスムターゼ(FSD)の発現は、SPL7依存的に銅欠乏下で上昇する(Bernal et al.,2012; Yamasaki et al., 2009).
(論文の囲み記事:核となる考え方)
・ 鉄を過剰に蓄積する3つの遺伝子型は、根の鉄取り込み遺伝子のアップレギュレーションを共有している。
・ 葉の反応は鉄過剰に対する反応と一致しており、遺伝子型によって異なる。
・ すべての遺伝子型の葉で発現が上昇した4つの遺伝子は、鉄欠乏の全身的シグナル伝達に関与している可能性が高い。
・ RNAのひとつは、IMA3転写産物の3′UTRを標的とする可能性の高いtRNA由来の断片を産生する可能性がある。
・ このtRNA由来の断片は、核にコードされたIMA3遺伝子に対する葉緑体からの逆行性制御を構成している可能性がある。
結論
鉄過剰蓄積型遺伝子型3種のトランスクリプトーム・プロファイルを、異なる鉄体制下で比較することで、鉄ホメオスタシスの新規調節因子、特に鉄状態の全身的シグナル伝達に関与する遺伝子を明らかにすることを目的とした。4つの遺伝子型に共通する遺伝子は、IRT1、FRO2、bHLHサブグループ1b転写因子など、確立された鉄欠乏応答遺伝子のほとんどであり、これらはすべて鉄の取り込みの増加と一致して発現が上昇した。At1g73120は、最も高発現を示した遺伝子の一つで、まだ未同定のF-boxタンパク質をコードしており、特に興味深い候補である。F-boxタンパク質は、ホルモンシグナル伝達への関与が確立されている。At1g73120はbHLHタンパク質FIT (FER-LIKE IRON DEFICIENCY INDUCED TRANSCRIPTION FACTOR) (Colangelo & Guerinot, 2004)によって制御されており、FRO2、IRT1、クマリン産生オキシゲナーゼF6'H1、S8H、CYP82C4などの鉄獲得に関与する遺伝子と密接に共発現している(atted.jp)。全体として、3つの遺伝子型間で最もよく重なり合ったのは、鉄欠乏根であった。一方、野生型の葉は、opt3変異株とIMA Ox株とでは反応が異なるようであった。これらの観察結果は、葉と根が自律的なFe感知機構を持つというモデルと一致している。顕著なことに、あるサンプル中のDEGsの数は、遺伝子誘導の強度に比例しており、鉄欠乏の対照植物で最も多く観察され、opt3-2およびIMAs Ox系統がそれに続いた。しかし、これらの遺伝子は、IMA3 Ox植物ではIMA1 Ox植物よりも発現量が少なかったが、IMA3 Ox植物はIMA1 Ox植物よりも鉄を蓄積していた。
興味深いことに、すべてのサンプルで特異的な発現パターンを示し、DEGとして検出されたプラスチドゲノムの2つの遺伝子座を同定した。これらの遺伝子座はtRNA-Alaを産生するようである。tRNA-Ala由来の断片がIMA3転写産物を標的とすることを示した以前の研究(Gu et al、2022) にもとずづき、我々は、これらの遺伝子座が、長い間待ち望まれていた、鉄の取り込みに関するプラスチドの逆行性制御に関与している可能性を提唱する。
(以下図の説明)
図1
鉄欠乏、IMA1およびIMA3の過剰発現、OPT3のノックダウンによって誘発される転写変化。
(A) 実験セットアップの概要。EYFP Ox(コントロール)、IMA1 Ox、IMA3 Ox、およびopt3-2変異植物の新芽と根のトランスクリプトーム・プロファイルを、コントロール条件下またはFe欠乏下で生育させた。
(B)差次的に発現していると同定された遺伝子とその発現に影響を与えた実験因子のまとめ。シュートおよび根の発現が異なる遺伝子(DEGs)は、シュートまたは根のいずれかの組織間の比較において、100万キロベースあたりのリード数(RPKM)が有意に異なる(p < 0.05)遺伝子として定義された。 Fe-regulated DEGs は、Fe-sufficient サンプルと Fe-deficient サンプルの間で少なくとも 1 つの差異がある遺伝子と定義した。その発現が、同じ条件下で生育させた対照植物の対応する組織で測定された発現と有意に異なっていた場合、遺伝子型が調節されていると考えられた。
図1A
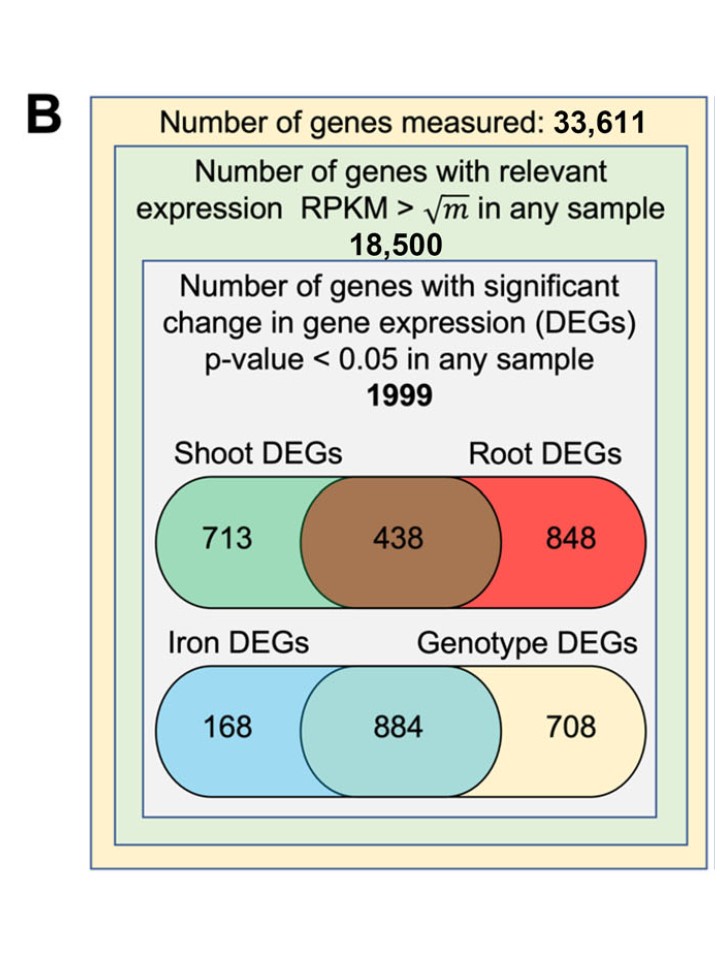
図1B