僀僱偵偍偗傞儅儞僈儞丄摵偍傛傃垷墧僩儔儞僗億乕僞乕偺惂屼偵偍偗傞OsbHLH156-OsIRO2揮幨場巕暋崌懱偺栶妱
偙偺榑暥偼Fe寚朢壓偱偺Zn,Mn,Cu偺僋儘僗僩乕僋偺堚揱巕敪尰斉偱偁傞丅巻柺偺搒崌忋恾偼丄Fig.1, Fig.4, Fig.5偺傒傪宖嵹偟偨丅屄恖揑偵嫽枴偑桸偄偨偺偱丄幚尡曽朄埲奜慡栿偟偨丅庴棟偝傟偰偄傞偑枹敪姧榑暥偱偁傞丅
丂
僀僱偵偍偗傞儅儞僈儞丄摵偍傛傃垷墧僩儔儞僗億乕僞乕偺惂屼偵偍偗傞OsbHLH156-OsIRO2揮幨場巕暋崌懱偺栶妱
Role of OsbHLH156-OsIRO2 transcription factor complex in regulating manganese, copper and zinc transporters in rice
丂
Jiamei Zhu, Jie Li, Xiaoying Hu, Jin Wang, Jing Fang, Shoudong Wang, Huixia Shou
State Key Laboratory of Plant Physiology and Biochemistry, College of Life Sciences, Zhejiang University, Hangzhou, Zhejiang 310058, China
Key Laboratory of Soybean Molecular Design Breeding, Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China
丂
庴棟偩偑枹宖嵹榑暥(懡暘J.exp.Bot)
丂
乮梫巪乯
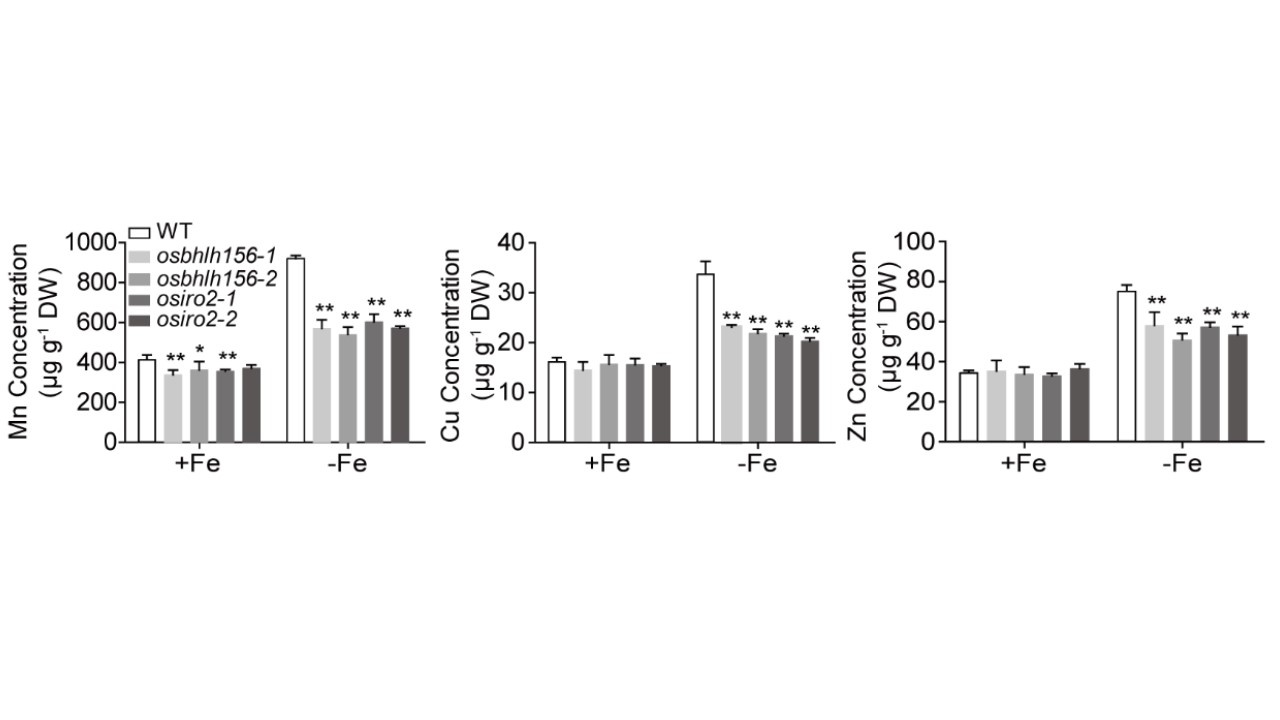
揝(Fe)丄儅儞僈儞(Mn)丄摵(Cu)丄垷墧(Zn)偼丄怉暔偺惉挿偲敪堢偵昁梫側昁恵旝検塰梴慺偱偁傞偑丄嵟揔儗儀儖傪挻偊傞偲撆惈傪帵偡偙偲偑偁傞丅怉暔偼丄偙傟傜偺嬥懏偺庢傝崬傒丄桝憲丄挋憼傪娷傓暋嶨側儂儊僆僗僞僔僗僱僢僩儚乕僋傪恑壔偝偣偰偒偨丅揝寚朢忦審壓偱偼丄揮幨場巕乮TF乯暋崌懱 OsbHLH156/OsIRO2 偑妶惈壔偝傟丄Strategy II 偺揝妉摼偵娭偡傞拞怱揑側惂屼場巕偲偟偰摥偔偙偲偑帵偝傟偨丅杮尋媶偱偼丄Mn丄Cu偍傛傃Zn偺媧廂偵偍偗傞TF暋崌懱偺栶妱傪昡壙偟偨丅揝寚朢偼僔儏乕僩偺 Mn丄Cu丄Zn 擹搙傪桳堄偵忋徃偝偣偨偑丄osbhlh156 偲 osiro2 曄堎懱偱偼偙傟傜偺擇壙嬥懏擹搙偺忋徃偑桳堄偵梷惂偝傟偨偙偲偐傜丄TF 暋崌懱偑 Mn丄Cu丄Zn 偺庢傝崬傒偲桝憲偵娭梌偟偰偄傞偙偲偑帵嵈偝傟偨丅RNA僔乕僋僄儞僔儞僌傾僢僙僀偵傛傝丄osbhlh156偍傛傃osiro2曄堎懱偱偼丄Mn丄Cu丄Zn偺庢傝崬傒偲桝憲偵娭楢偡傞堚揱巕偑桳堄偵梷惂偝傟偰偄傞偙偲偑帵偝傟偨丅揮幨妶惈壔傾僢僙僀偵傛傝丄TF暋崌懱偼OsIRT1丄OsYSL15丄OsNRAMP6丄OsHMA2丄OsCOPT1/7丄OsZIP5/9/10偺僾儘儌乕僞乕偵捈愙寢崌偟丄偦傟傜偺敪尰傪妶惈壔偱偒傞偙偲偑帵偝傟偨丅偝傜偵丄TF暋崌懱偼僯僐僠傾僫儈儞乮NA乯偲2'僨僆僉僔儉僊僯儞巁乮DMA乯崌惉堚揱巕偺敪尰傪妶惈壔偡傞偺偵昁梫偱偁傝丄偙傟傜偼Mn丄Cu丄Zn偺庢傝崬傒偲桝憲傪懀恑偡傞丅偝傜偵丄OsbHLH156偲OsIRO2偼Cu偺拁愊傪懀恑偟丄揝寚朢徢忬傪晹暘揑偵夞暅偝偣偨丅傑偲傔傞偲丄OsbHLH156偲OsIRO2 TF偼丄揝偺儂儊僆僗僞僔僗偩偗偱側偔丄Mn丄Cu丄Zn偺拁愊偵偍偄偰傕拞怱揑側惂屼場巕偲偟偰婡擻偟偰偄傞丅
乮偼偠傔偵乯
揝乮Fe乯丄儅儞僈儞乮Mn乯丄摵乮Cu乯丄垷墧乮Zn乯偺傛偆側旝検塰梴慺偼丄怉暔偺寬慡側惉挿偲敪堢偺偨傔偵丄傢偢偐側擹搙斖埻偱惓妋偵堐帩偝傟側偗傟偽側傜側偄昁恵尦慺偱偁傞丅偙傟傜偺嬥懏偺寚朢傗夁忚偼丄怉暔偺惗棟妛揑丒惗壔妛揑僾儘僙僗偵怺崗側僟儊乕僕傪梌偊傞乮Alejandro傜丄2020丟Bashir傜丄2021丟Zahra傜丄2021丟Kirk傜丄2022乯丅偟偨偑偭偰丄Fe丄Mn丄Cu丄Zn偺姶抦丄僔僌僫儖揱払丄桝憲丄偍傛傃偙傟傜偺塰梴慺儗儀儖傪堐帩偡傞儊僇僯僘儉娫偺僋儘僗僩乕僋傪惓妋偵惂屼偡傞昁梫偑偁傞丅尋媶偵傛傝丄偙傟傜偺嬥懏偼怉暔慻怐偵偍偄偰屳偄偺儂儊僆僗僞僔僗偵塭嬁傪媦傏偡偙偲偑帵偝傟偰偄傞乮Rout et al.,2015乯 摿偵丄揝偺寚朢偼丄扨巕梩怉暔庬偲憃巕梩怉暔庬偺椉曽偵偍偄偰丄懠偺3尦慺偺庢傝崬傒偲桝憲傪寑揑偵挷惍偡傞壜擻惈偑偁傞丅揝偼丄Mn丄Cu丄Zn偲摨偠惗暔妛揑僾儘僙僗偺懡偔偵娭梌偟偰偄傞丅偡側傢偪丄僋儘儘僼傿儖崌惉偲岝崌惉乮Fe丄Mn丄Cu乯丄儈僩僐儞僪儕傾屇媧乮Fe丄Mn丄Cu乯丄巁壔僗僩儗僗曐岇乮Fe丄Mn丄Cu丄Zn乯丄拏慺戙幱乮Fe丄Mn丄Cu乯丄昦尨懱杊屼乮Fe丄Cu乯丄峺慺曗場巕乮Fe丄Mn丄Cu丄Zn乯側偳偱偁傞乮Hansch and Mendel, 2009; Zhao et al., 2012; Kobayashi et al., 2019乯丅偟偐偟丄揝偺儂儊僆僗僞僔僗偲Mn丄Cu丄Zn儗儀儖偲偺僋儘僗僩乕僋偺崻掙偵偁傞暘巕儊僇僯僘儉偼丄姰慡偵偼夝柧偝傟偰偄側偄丅
丂
揝偼搚忞拞偵朙晉偵懚嵼偡傞偑丄傎偲傫偳偺揝偼晄梟惈偺悈巁壔戞擇揝偺宍偱懚嵼偟丄揝偺棙梡岠棪傪戝偒偔掅壓偝偣傞偨傔丄怉暔偼埶慠偲偟偰揝寚朢偺儕僗僋偵偝傜偝傟偰偄傞丅偙偺栤戣偵懳張偡傞偨傔丄怉暔偼2偮偺揝妉摼愴棯傪恑壔偝偣偰偒偨丅僔儘僀僰僫僘僫偺傛偆側旕壯杮怉暔偱偼娨尦愴棯乮愴棯I乯丄僀僱偺傛偆側壯杮怉暔偱偼僉儗乕僩愴棯乮愴棯II乯偱偁傞乮Kobayashi and Nishizawa, 2012; Kobayashi et al.,2019乯 愴棯I傪梡偄傞怉暔偼丄3偮偺僗僥僢僾傪宱偰揝傪妉摼偡傞丗 傑偢丄崻嵶朎偑僼僃僲乕儖壔崌暔偲僾儘僩儞傪暘斿偟偰Fe傪摦堳偟丄揝傪傛傝壜梟惈偵偡傞乮Santi et al., 2005乯丅師偵丄峺慺FRO2偑Fe(III)傪Fe(II)偵娨尦偟乮Robinson et al., 1999; Connolly et al., 2003乯丄嵟屻偵Fe(II)偑IRON-REGULATED TRANSPORTER 1(IRT1)偵傛偭偰嵶朎撪偵桝憲偝傟傞乮Korshunova et al., 1999; Vert et al., 2002乯丅愴棯II怉暔偱偼丄儉僊僱巁僼傽儈儕乕僼傿僩僔僨儘僼僅傾乮MA乯偑崻寳偵暘斿偝傟丄儉僊僱巁僼傽儈儕乕僼傿僩僔僨儘僼僅傾偺僩儔儞僗億乕僞乕1乮TOM1乯傪夘偟偰Fe(III)傪僉儗乕僩偡傞乮Ma and Nomoto, 1993; Ma et al丄 1995; Nozoye et al., 2011乯丄僉儗乕僩懱乮Fe(III)-MA乯偼YELLOW STRIPE-LIKE 僩儔儞僗億乕僞乕乮YSL乯偵傛偭偰嵶朎撪偵桝憲偝傟傞乮Curie et al., 2001; Inoue et al., 2009乯 崻偵庢傝崬傑傟偨屻丄揝偼傑偢昞旂嵶朎偐傜堐娗懇偵桝憲偝傟丄僇僗僷儕傾儞僗僩儕僢僾傪宱桼偡傞嫟宍惉偍傛傃傾億僾儔僗僥傿僢僋儖乕僩傪宱偰丄摫娗傑偨偼梩宻晧壸傪夘偟偰崻偐傜夎偵堏峴偡傞乮Kobayashi and Nishizawa, 2012; Kobayashi et al.,2019乯 怉暔懱撪偱偼丄壜梟惈Fe(II)偺怺崗側撆惈偲Fe(嘨)偺掅偄梟夝惈偺偨傔偵丄Fe(II)偲Fe(嘨)偺椉曽偑僉儗乕僩偝傟側偗傟偽側傜側偄丅怉暔懱撪偱偺Fe(嘦)偍傛傃懠偺慗堏嬥懏偺桝憲傪懀恑偡傞偨傔偺廳梫側嬥懏僉儗乕僩嵻偺傂偲偮偑NA偱偁傝丄偙傟偼3偮偺NA崌惉峺慺丄OsNAS1丄OsNAS2偍傛傃OsNAS3偵傛偭偰崌惉偝傟傞乮Inoue et al.,2003乯 DMA偼NA偺峔憿椶帡懱偱丄僯僐僠傾僫儈儞傾儈僲僩儔儞僗僼僃儔乕僛乮NAAT乯偲僨僆僉僔儉僊僱巁崌惉峺慺乮DMAS乯偵傛偭偰NA偐傜崌惉偝傟傞丅DMA偼Fe(III)偺僉儗乕僞乕偲偟偰僀僱偺摫娗偍傛傃梩宻偐傜専弌偝傟偰偄傞乮Mori傜丄1991乯丅
丂
揝寚朢偼丄僔儘僀僰僫僘僫傗僀僱偵偍偄偰丄Mn丄Cu丄Zn偺傛偆側懠偺2壙嬥懏偺拁愊傪憹壛偝偣傞乮Barberon傜丄2014丟Cai傜丄2021丟Cheng傜丄2007丟Long傜丄2010丟Waters傜丄2012乯丅堦曽偱偼丄偄偔偮偐偺枩擻嬥懏僩儔儞僗億乕僞乕偺慖戰惈偑掅偄偨傔偱偁傞丅AtIRT1偼垷墧丄儅儞僈儞丄僐僶儖僩丄僇僪儈僂儉側偳偺旕揝嬥懏傪桝憲偡傞偙偲偑偱偒乮Rogers傜丄2000丟Vert傜丄2002乯丄AtNRAMP1偼揝埲奜偵儅儞僈儞傗僇僪儈僂儉傕桝憲偡傞偙偲偑偱偒傞乮Curie傜丄2000丟 Thomine et al., 2000; Cailliatte et al., 2010乯丅堦曽丄懡偔偺旕揝嬥懏僩儔儞僗億乕僞乕偑揝寚朢僗僩儗僗偵傛偭偰桿摫偝傟傞偙偲偑傢偐偭偨丅摵庢傝崬傒堚揱巕 AtCOPT2丄AtFRO4丄AtFRO5 偺敪尰偼丄揝寚朢壓偱 AtFIT乮Fer-Like Iron Deficiency-Induced Transcription Factor乯偵傛偭偰忋徃偟偨乮Cai et al.,2021乯 AtMTP8 (Metal Tolerance Protein 8)偼掅揝忦審壓偱嫮偔桿摫偝傟丄僔儘僀僰僫僘僫偵偍偗傞揝塰梴偲Mn偺漢峈揑姳徛傪杊偖偺偵廳梫側栶妱傪壥偨偟偰偄傞(Eroglu et al., 2015)丅AtMTP3偼丄揝寚朢壓偱僔儏乕僩偐傜偺Zn偺攔弌傪拠夘偡傞偙偲偑尒弌偝傟偨(Arrivault et al., 2006)丅AtIREG2 (Iron-regulated membrane protein 2)傕揝寚朢僗僩儗僗偱桿摫偝傟丄僩僲僾儔僗僩偵嬊嵼偟丄僯僢働儖丄揝丄僐僶儖僩傪塼朎偵妘棧偡傞 (Schaaf et al., 2006; Morrissey et al., 2009)丅
丂
嵟嬤丄墫婎惈傜偣傫-儖乕僾僿儕僢僋僗乮bHLH乯TF OsbHLH156偑庡梫側惂屼場巕OsIRO2偲暔棟揑偵憡屳嶌梡偟乮Ogo et al., 2006; 2007乯丄僀僱偺揝寚朢帪偵Strategy II堚揱巕偺敪尰傪惂屼偡傞妀嬊嵼傪懀恑偡傞偙偲偑尒偄偩偝傟偨乮Wang et al., 2020乯 暿偺僌儖乕僾偼丄OsbHLH156偑僔儘僀僰僫僘僫偺FIT偲攝楍偑帡偰偄傞偙偲偐傜OsFIT偲柦柤偟偨乮Liang et al..2020乯 OsbHLH156/OsFIT偲OsIRO2偺偄偢傟偐偑寚懝偡傞偲丄僀僱偼儉僊僱巁乮MA乯傪崌惉偱偒偢丄Fe(III)-MA暋崌懱傪夘偟偰Fe(III)傪庢傝崬傓偙偲偑偱偒側偔側傞丅堦曽丄揝寚朢偵傛偭偰桿摫偝傟傞揝(II)桝憲懱OsIRT2偲OsNRAMP1偼TF暋崌懱偵傛偭偰惂屼偝傟偢丄OsIRT1偼晹暘揑偵惂屼偝傟偰偄傞偵夁偓側偄丅偟偨偑偭偰丄偙偺曄堎懱偼丄OsIRT1丄OsIRT2丄OsNRAMP1傪捠偠偰Fe乮II乯傪庢傝崬傓偙偲偑偱偒傞偨傔丄Fe乮II乯傪嫙媼偟偰傕尠挊側僋儘儘僔僗徢忬傪帵偝側偐偭偨乮Wang et al.,2020乯 偟偐偟丄OsbHLH156偲OsIRO2偑Mn丄Cu丄Zn偺庢傝崬傒偲桝憲傪惂屼偟偰偄傞偐偳偆偐丄傑偨偳偺傛偆偵惂屼偟偰偄傞偐偼晄柧偱偁傞丅杮尋媶偱偼丄OsbHLH156偲OsIRO2偑丄揝丄Mn丄Cu丄Zn偺庢傝崬傒偲桝憲偵娭楢偡傞堚揱巕傗NA崌惉堚揱巕偺僾儘儌乕僞乕偵捈愙寢崌偟丄偦傟傜偺敪尰傪妶惈壔偡傞偙偲偱丄僀僱偵偍偗傞揝偲Mn丄Cu丄Zn偲偺僋儘僗僩乕僋傪挷愡偡傞偙偲傪柧傜偐偵偟偨丅
丂
丂
乮峫嶡乯
怉暔偵偍偗傞揝寚朢僗僩儗僗偼丄Mn丄Cu丄Zn偺拁愊偲丄偙傟傜偺旝検塰梴慺偺僩儔儞僗億乕僞乕傪僐乕僪偡傞堚揱巕偺敪尰儗儀儖偺椉曽傪挊偟偔桿摫偡傞偙偲偑偱偒傞丅偙偺嵟傕堦斒揑側愢柧偼丄IRT1傗NRAMPs偺傛偆側偄偔偮偐偺枩擻嬥懏僩儔儞僗億乕僞乕偑丄偙傟傜偺擇壙嬥懏傪庢傝崬傓慖戰惈偑掅偄偙偲偱偁傞丅杮尋媶偱偼丄揝寚朢偵傛偭偰桿摫偝傟傞 OsbHLH156-OsIRO2 TF 暋崌懱偑 Mn丄Cu丄Zn 偺儂儊僆僗僞僔僗偵壥偨偡栶妱傪挷傋偨丅揝寚朢壓偱偺Mn丄Cu丄Zn擹搙偺忋徃偼丄OsbHLH156-OsIRO2 TF暋崌懱偵戝偒偔埶懚偟偰偄偨丅OsbHLH156-OsIRO2 TF暋崌懱偼丄嬥懏僩儔儞僗億乕僞乕堚揱巕偺揮幨傪妶惈壔偡傞偩偗偱側偔丄Fe丄Mn丄Cu丄Zn偺庢傝崬傒偲桝憲偵廳梫側嬥懏僉儗乕僞乕偱偁傞NA偲DMA偺崌惉傕妶惈壔偡傞丅暋崌懱拞偺偄偢傟偐偺TF偑寚懝偡傞偲丄Mn丄Cu丄Zn偺拁愊偑挊偟偔尭彮偟偨乮恾1乯丅
丂
OsbHLH156-OsIRO2暋崌懱偼棨忋忦審壓偱桳岠偱偁傞
丂
僀僱偼丄Fe(II)庢傝崬傒婡峔乮Strategy I-like乯偲Fe(III)庢傝崬傒婡峔乮Strategy II乯偺椉曽傪帩偭偰偄傞丅OsbHLH156-OsIRO2暋崌懱偼丄Fe(III)偑庡梫側揝尮偱偁傞棨忋忦審壓偱婡擻偡傞偙偲偐傜丄Mn丄Cu丄Zn偺儂儊僆僗僞僔僗偵懳偡傞TF暋崌懱偺栶妱偼丄庡偵棨忋忦審壓偱惗偠傞偼偢偱偁傞丅
堦曽丄IRT傗NRAMP宆僩儔儞僗億乕僞乕偺傛偆側慖戰惈偺掅偄嬥懏僩儔儞僗億乕僞乕偼丄庡偵扻悈忦審壓偱岠壥傪敪婗偡傞偼偢偱偁傞丅崱屻丄扻悈張棟偲棨忋張棟偺椉曽傪梡偄偨尋媶偵傛傝丄僀僱偵偍偗傞Fe偲Mn丄Cu丄Zn偺僋儘僗僩乕僋偵娭梌偡傞儊僇僯僘儉偺憡懳揑廳梫惈偑偝傜偵夝柧偝傟傞壜擻惈偑偁傞丅
丂
OsbHLH156-OsIRO2 TF暋崌懱偺捈愙昗揑僩儔儞僗億乕僞乕偺掅慖戰惈
丂
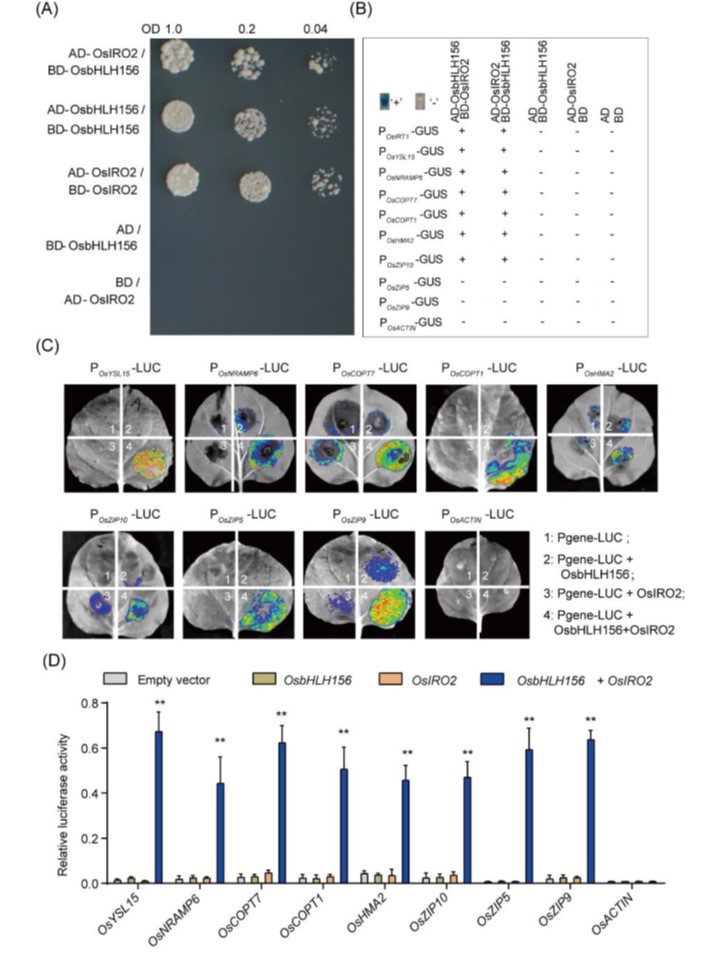
旝検塰梴慺偱偁傞Mn丄Cu丄Zn偺婡擻偼丄廳梫側戙幱偵枾愙偵娭楢偟偰偄傞丅偙傟傜偺儂儊僆僗僞僔僗偼丄拁愊偵傛傞巁壔彎奞傪旔偗傞偨傔偵丄惗暔妛揑婡擻偵嵟揔側擹搙傪堐帩偡傞傛偆偵尩枾偵惂屼偝傟側偗傟偽側傜側偄丅Strategy-I怉暔庬偱偁傞僔儘僀僰僫僘僫偼丄FRO偵傛偭偰娨尦偝傟偨揝(II)傪庢傝崬傓偨傔偵丄庡偵IRT僞僀僾偲NRAMP僞僀僾偺僩儔儞僗億乕僞乕傪梡偄偰偄傞丅扺悈忦審偵揔墳偟偨僀僱偼丄僔儘僀僰僫僘僫偲摨條偺Fe(II)僩儔儞僗億乕僞乕傪傕梡偄偰丄Fe(II)庢傝崬傒宯傪傕桳偡傞Strategy II偺怉暔庬偺椺奜偱偁傞丅懡偔偺尋媶偑丄嬥懏桝憲僼傽儈儕乕偺偄偔偮偐偼旕慖戰揑偱偁傞偙偲傪帵偟偰偄傞丅揝桝憲懱IRT1偼丄幚偼僔儘僀僰僫僘僫偱傕僀僱偱傕晛曊揑側嬥懏桝憲懱偱偁傞丅OsIRT1偼僀僱偵偍偄偰揝丄僇僪儈僂儉丄垷墧傪桝憲偡傞偙偲偑帵偝傟偨丅OsbHLH156-OsIRO2 TF暋崌懱傪夘偟偨揝寚朢偵傛傞OsIRT1偺桿摫偼丄揝寚朢壓偱偺Mn丄Cu丄Zn偺拁愊偵婑梌偡傞偲峫偊傜傟傞丅偝傜偵丄OsNRAMP6偲OsHMA2傕旕慖戰揑嬥懏桝憲偺岓曗偱偁傞偲峫偊傜傟傞丅OsNRAMP1丄3丄5丄6 偼揝丄僇僪儈僂儉丄儅儞僈儞傪桝憲偡傞偙偲偑帵偝傟丄OsNRAMP6偼揝偲儅儞僈儞傪桝憲偡傞偙偲偑摨掕偝傟偨丅廳嬥懏ATPase僼傽儈儕乕偺僩儔儞僗億乕僞乕OsHMA2偼丄Fe2+偲Zn2+偺椉曽傪桝憲偡傞偙偲偑帵偝傟偨丅偟偨偑偭偰丄揝寚朢忦審壓偱偼丄妶惈宆OsbHLH156-OsIRO2 TF暋崌懱偑OsNRAMP6偲OsHMA2偺敪尰傪捈愙桿敪偟乮恾3乯丄揝寚朢壓偱Mn丄Cu丄Zn偺拁愊傪憹壛偝偣傞壜擻惈偑偁傞丅懠偺捈愙昗揑偱偁傞OsCOPT1/7偲OsZIP5/9/10偼丄偦傟偧傟庡偵Cu偲Zn傪桝憲偟丄揝寚朢壓偱懳墳偡傞嬥懏娷検偺拁愊偵婑梌偡傞丅
丂
嬥懏尦慺偺拁愊偵偍偗傞嬥懏僉儗乕僞乕NA偲DMA偺栶妱
丂
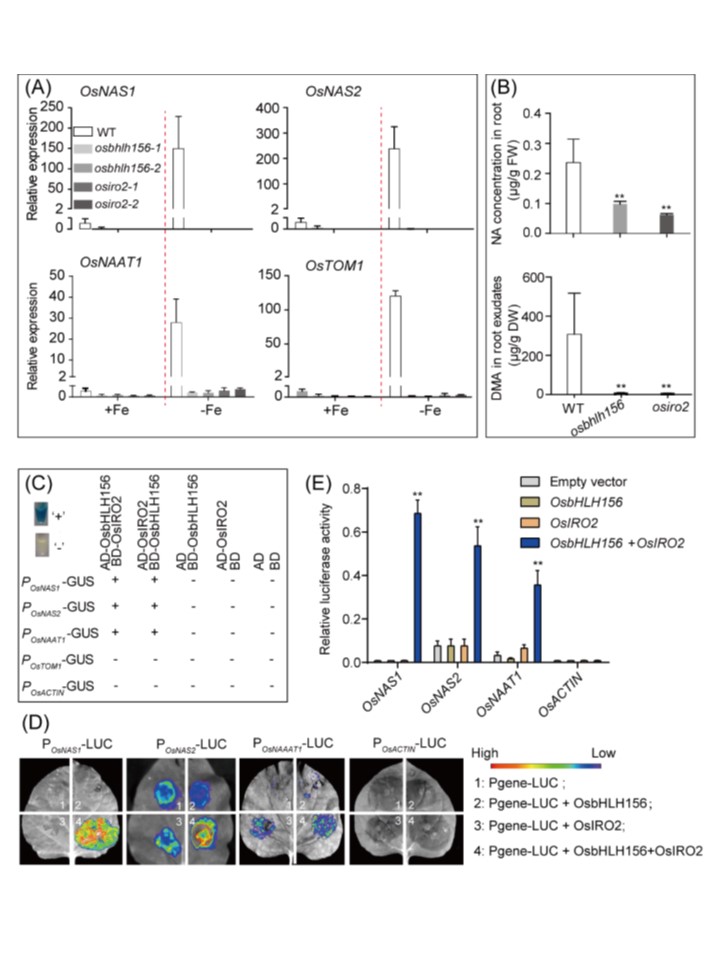
揝寚朢壓偱妶惈壔偟偨OsbHLH156-OsIRO2 TF暋崌懱偼丄OsNAS1偲OsNAS2偺敪尰傪桿摫偟丄NA偺拁愊傪憹壛偝偣偨乮恾5A偍傛傃5B乯丅NA偼丄摫娗偵偍偗傞揝丄摵丄僯僢働儖偺堏摦偵廳梫側暘巕偲偟偰抦傜傟偰偍傝乮Curie et al. 僔儘僀僰僫僘僫偲偼堎側傝丄愴棯I怉暔偱偁傞僀僱偼丄NA傪婎幙偲偟偰DMA傪崌惉偟丄搚忞拞偵暘斿偟偰Fe(III)傪僉儗乕僩壔偡傞偙偲偑偱偒傞丅DMA-Fe(III)暋崌懱偼丄YSL僞儞僷僋幙偵傛偭偰桝憲偝傟丄摫娗傗梩宻偵塣偽傟偰丄Fe傗偍偦傜偔懠偺嬥懏傪挿嫍棧桝憲偡傞偙偲偑偱偒傞乮Mori傜丄1991乯丅
丂
摵偺嫙媼傪憹傗偡偲揝寚朢徢忬偑娚榓偝傟傞
丂
Cu偲Fe偼丄懡嵶朎惗暔偵偍偗傞嬥懏偺棙梡壜擻惈偵墳偠偰丄懡偔偺怉暔偱摨偠惗壔妛斀墳傪怗攠偡傞峺慺偲偟偰岎屳偵棙梡偝傟傞丅偙傟傑偱偺尋媶偱丄摵娭楢堚揱巕偼揝寚朢偵傛偭偰惂屼偝傟丄揝寚朢壓偱偼摵傪娷傓僗乕僷乕僆僉僔僪僕僗儉僞乕僛乮SOD乯偑揝傪娷傓SOD偵戙傢偭偰妶惈巁慺庬傪徚嫀偡傞壜擻惈偑帵偝傟偰偄傞丅僔儘僀僰僫僘僫偱偼丄揝寚朢偼FIT偲bHLH Ib偵攠夘偝傟偨摵庢傝崬傒堚揱巕乮AtCOPT2丄AtFRO4丄AtFRO5乯偺敪尰傪桿摫偟丄摵偺拁愊傪憹壛偝偣偨丅撪場惈摵擹搙偺憹壛偼丄Cu/ZnSOD 傊偺曗峺慺嫙媼傪懀恑偟丄揝娷桳 SOD 偺尭彮傪曗偆偙偲偑偱偒傞偨傔丄怉暔偺揝寚朢僗僩儗僗偵懳偡傞懴惈偑嫮壔偝傟傞丅杮尋媶偱偼丄osbhlh156 偲 osiro2 偵偍偄偰丄Cu 寚朢忦審壓偱揝寚朢徢忬偑尰傟偨偑丄懳徠忦審壓偱偼尰傟 側偐偭偨偙偲偐傜乮恾 7B乯丄Cu 偺嫙媼偼丄揝寚朢偵傛傞妶惈巁慺庬偺拁愊傪梷偊傞偙偲偱梩偺僋儘儘僔僗傪 娚榓偱偒傞偙偲偑帵嵈偝傟偨丅幚嵺丄摵偺夁忚嫙媼偼揝寚朢傪偁傞掱搙曗偆偙偲偑偱偒偨丅
丂
OsbHLH156/OsIRO2偑僀僱偺僔儏乕僩偵偍偄偰Mn丄Cu丄Zn偺拁愊傪懀恑偡傞偲偄偆嶌嬈儌僨儖丅
丂
埲忋偺偙偲偐傜丄僀僱偵偍偗傞Mn丄Cu丄Zn偺桝憲偵偍偗傞OsbHLH156偲OsIRO2偺嶌嬈儌僨儖傪採埬偡傞丅揝寚朢壓偱偼丄OsbHLH156偲OsIRO2偑嫮偔桿摫偝傟傞丅傛傝崅儗儀儖偺OsbHLH156 TF偼丄OsIRO2偺妀撪傊偺怤擖傪彆偗丄偦偺屻OsIRO2偲暋崌懱傪宍惉偟丄暋悢偺曽朄偱Mn丄Cu丄Zn桝憲傪惂屼偡傞壜擻惈偑偁傞丗(i) 懠偺2壙嬥懏傕桝憲偱偒傞揝僩儔儞僗億乕僞乕偺桿摫 (ii) Mn2+丄Cu2+丄Zn2+傕僉儗乕僩偱偒傞NA傗DMA偺傛偆側嬥懏僉儗乕僞乕偺桿摫 (iii) Mn丄Cu丄Zn偺庢傝崬傒偲堏摦偺忋棳偺僔僌僫儖揱払宱楬偵塭嬁傪梌偊傞堚揱巕惂屼乮恾3丄4乯丅嵟廔揑偵丄揝寚朢壓偱偼Mn丄Cu丄Zn擹搙偑忋徃偡傞丅
丂
丂
丂
埲壓恾偺杴椺
恾1. OsbHLH156偲OsIRO2偼Mn丄Cu丄Zn偺庢傝崬傒偲堏摦傪惂屼偡傞丅怉暔偼丄揝傪揧壛傑偨偼柍揧壛偺悈峩嵧攟偱惗堢偝偣偨丅WT姅丄osbhlh156姅丄osiro2姅偐傜丄10擔娫丄揝暘廩懌傑偨偼揝暘寚朢忦審壓偱惗堢偝偣偨怴夎傪嵦庢偟偨丅尦慺暘愅偵偼丄撈棫偟偨3姅偱3夞偺應掕傪峴偭偨丅Mn丄Cu丄Zn 偺擹搙偼 ICP-MS 偱應掕偟偨丅僨乕僞偼暯嬒抣亇SD丄n = 3; *, P < 0.05; **, P < 0.01 (Student's t-test).
丂
恾4. OsbHLH156-OsIRO2暋崌懱偼丄Fe丄Mn丄Cu偍傛傃Zn僩儔儞僗億乕僞乕堚揱巕偺妶惈壔偵昁梫偱偁傞丅
(A乯峺曣僣乕僴僀僽儕僢僪傾僢僙僀丅OsbHLH156偲OsIRO2傪GAL4妶惈壔僪儊僀儞乮AD乯傑偨偼GAL4 DNA寢崌僪儊僀儞乮BD乯偲梈崌偝偣偨丅敪尰儀僋僞乕偺堎側傞慻傒崌傢偣傪峺曣嵶朎乮Saccharomyces cerevisiae AH109乯偵堏怉偟偨丅堎側傞峺曣姅傪丄10mM偺3-AT乮3-傾儈僲-1,2,4-僩儕傾僝乕儖乯傪揧壛偟偨慖戰攟抧QDO忋偵僾儗乕僥傿儞僌偟偨丅嬻儀僋僞乕(AD)偲(BD)傪僱僈僥傿僽僐儞僩儘乕儖偲偟偰梡偄偨丅
(B乯揮幨妶惈壔傾僢僙僀丅GUS堚揱巕傪昗揑堚揱巕偺僱僀僥傿僽僾儘儌乕僞乕偲梈崌偝偣丄OsbHLH156傕偟偔偼OsIRO2丄傑偨偼偦偺椉曽偲峺曣拞偱嫟敪尰偝偣偨丅峺曣嵶朎傪慖戰攟抧乮-Trp, -Leu, -Ura乯忋偱憹怋偝偣丄GUS僶僢僼傽乕傪梡偄偰愼怓偟偨丅惵怓乮亄乯偼儗億乕僞乕堚揱巕GUS偑揮幨偝傟偨偙偲傪帵偟偨丅
(C) 傾僌儘僶僋僥儕僂儉怹弫僞僶僐梩偵偍偗傞儖僔僼僃儔乕僛偺敪尰丅8偮偺僾儘儌乕僞乕-儖僔僼僃儔乕僛梈崌懱乮Pgene-LUC乯偺偦傟偧傟傪丄慻姺偊揮幨場巕側偟偱乮1乯丄OsbHLH156乮2乯傑偨偼OsIRO2乮3乯偺偄偢傟偐偱丄偁傞偄偼OsbHLH156偲OsIRO2偺椉曽偱乮4乯丄僞僶僐梩拞偱敪尰偝偣偨丅OsACTIN1偺僾儘儌乕僞乕傪僱僈僥傿僽僐儞僩儘乕儖偲偟偰梡偄偨乮嵟屻偺僷僱儖乯丅(d乯儖僔僼僃儔乕僛妶惈丅憡懳儖僔僼僃儔乕僛妶惈偼儀僋僞乕僐儞僩儘乕儖偲斾妑偟偰寁嶼偟偨丅3夞偺撈棫偟偨幚尡傪峴偭偨丅僨乕僞偼暯嬒抣亇SD乮n = 3乯傪昞偡丟**丆P < 0.01(Student's t-test)丅
丂
恾5. NA偲DMA偺惗崌惉偼OsbHLH156-OsIRO2 TF暋崌懱偵傛偭偰捈愙惂屼偝傟偰偄傞丅
(A乯NA偲DMA偺崌惉偍傛傃DMA暘斿偵娭梌偡傞堚揱巕偺敪尰丅怉暔傪10擔娫丄揝寚朢梟塼傑偨偼揝嫙媼晄懌梟塼拞偱惗堢偝偣偨丅OsACTIN1偼僒儞僾儖傪昗弨壔偡傞偨傔偺撪晹懳徠偲偟偰梡偄偨丅
(B乯NA偍傛傃暘斿偝傟偨DMA娷検丅揝寚朢壓偱丄WT丄osbhlh156偍傛傃osiro2偐傜丄崻拞偺NA検偍傛傃崻偐傜暘斿偝傟傞DMA検傪専弌偟偨丅
(C) 揮幨妶惈壔傾僢僙僀丅GUS堚揱巕傪4偮偺昗揑堚揱巕偺偆偪偺1偮偺僱僀僥傿僽僾儘儌乕僞乕偲梈崌偝偣丄OsbHLH156傕偟偔偼OsIRO2丄傑偨偼偦偺椉曽偲峺曣拞偱嫟敪尰偝偣偨丅OsACTIN1偺僾儘儌乕僞乕偼僱僈僥傿僽僐儞僩儘乕儖偲偟偰梡偄偨丅
(D乯傾僌儘僶僋僥儕僂儉怹弫僞僶僐梩偵偍偗傞儖僔僼僃儔乕僛偺敪尰丅4偮偺僾儘儌乕僞乕-儖僔僼僃儔乕僛梈崌懱乮Pgene-LUC乯偺偦傟偧傟傪丄慻姺偊揮幨場巕側偟偱乮1乯丄OsbHLH156乮2乯傑偨偼OsIRO2乮3乯偺偄偢傟偐偱丄偁傞偄偼OsbHLH156偲OsIRO2偺椉曽偱乮4乯丄僞僶僐梩拞偱敪尰偝偣偨丅OsACTIN1偺僾儘儌乕僞乕傪僱僈僥傿僽僐儞僩儘乕儖偲偟偰梡偄偨乮嵟屻偺僷僱儖乯丅
(E乯儖僔僼僃儔乕僛妶惈丅憡懳儖僔僼僃儔乕僛妶惈偼儀僋僞乕僐儞僩儘乕儖偲斾妑偟偰寁嶼偟偨丅3夞偺撈棫偟偨幚尡傪峴偭偨丅僨乕僞偼暯嬒抣亇SD乮n = 3乯傪昞偡丟**丆P < 0.01(Student's t-test)丅
丂
恾1
恾4
恾5