植物体内における送達相補性(DCIP)により、植物におけるペプチドを介したタンパク質送達効率の測定が可能になる
以下はアメリカ学派による、タンパク質の直接的な葉面吸収を定量的に測定する手法を開発したという論文である。農業への応用も期待できるかもしれない。
植物体内における送達相補性(DCIP)により、植物におけるペプチドを介したタンパク質送達効率の測定が可能になる
Jeffrey W. Wang, Henry J. Squire, Natalie S. Goh, Heyuan Michael Ni, Edward Lien, Cerise Wong、Eduardo González-Grandío & Markita P. Landry
1 Department of Chemical and Biomolecular Engineering, University of California, Berkeley, Berkeley, CA 94720, USA. 2 Department of Molecular and Cell
Biology, University of California, Berkeley, Berkeley, CA 94720, USA. 3 Plant Molecular Genetics Department, Centro Nacional de Biotecnología-CSIC, Campus
Universidad Autónoma de Madrid, Madrid, Spain. 4 Innovative Genomics Institute, Berkeley, CA 94720, USA. 5 California Institute for Quantitative Biosciences,
University of California, Berkeley, Berkeley, CA 94720, USA. 6 Chan Zuckerberg Biohub, San Francisco, CA 94063, USA. ✉email: landry@berkeley.edu
COMMUNICATIONS BIOLOGY | (2023) 6:840 | https://doi.org/10.1038/s42003-023-05191-5 | www.nature.com/commsbio
(要約)
蛍光相補アッセイであるDelivered Complementation in Planta (DCIP)を用いて、我々はN. benthamiana(ニコチアナ・ベントハミアナ)において、細胞透過性ペプチドを介したペプチドや組換えタンパク質の細胞質への送達を実証した。
DCIPにより、タンパク質の送達効率を定量的に測定することが可能になり、細胞透過性ペプチドの機能的スクリーニングが可能であることを示した。
最後に、我々はDCIPが細胞透過性ペプチドを介したmCherryやLifeactのような組換え発現タンパク質のインプラントへのデリバリーを検出することを示した。
また、組換え植物転写因子WUSCHEL(AtWUS)のN. benthamianaへの導入も実証した。
シロイヌナズナの苗におけるAtWUS導入のRT-qPCR解析から、導入されたWUSはAtWUSの過剰発現によって誘導される転写変化を再現できることも示唆された。
これらの結果を総合すると、DCIPは植物におけるタンパク質の細胞質送達を調べるための新しく強力なツールであり、植物生理学を工学的に研究するための将来の道筋を明らかにするものである。
(まえがき)
:::::(略)
植物におけるタンパク質送達の成功を定量化するツールの欠如の理由は、蛍光代理カーゴの送達を検証するために、ほぼ普遍的に共焦点顕微鏡に依存しているためである。
しかし、植物組織における共焦点顕微鏡法には、以下のような独特の問題がある。
アーチファクトとシグナルを区別し、蛍光代理カーゴの絶対的定量化を行うのは困難であることである。
そこで我々は、細胞壁で覆われた植物組織における異なる大きさのたんぱく質の送達を確認するための、多用途で曖昧さのないプラットフォームを開発した。
我々は、アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)発現を介した、GFP相補性に基づく、共焦点顕微鏡を用いた植物へのタンパク質導入検出のための赤/緑レシオメトリックセンサーを設計した(DCIP, Delivered Complementation in planta)。
この技術では、sfGFPはより大きな非蛍光性断片(sfGFP1-10)と小さなペプチド鎖(GFP11)に分割される。
GFP11がsfGFP1-10と同じコンパートメントに送達されると、初めてGFP蛍光が再構成される(図1a)。
この方法には、ペプチド・タグが無傷のまま細胞質に送達され、溶菌小器官に封じ込められたり、アポプラストに閉じ込められたりしない場合にのみシグナルを発するという重要な利点がある。
GFP11もまた、優れたレポータータグとして機能する。その短い長さ(16AA)は化学合成が可能であり、また リコンビナントタンパク質に末端タグとして組換えタンパク質に容易に組み込むことができるからである。
組織内で自動画像解析を行い、解析中のバイアスのリスクを減らしたいという願いも、DCIPの最終的な設計の指針になった。
二分子蛍光相補法やナノルシフェラーゼ相補法は、哺乳類細胞における細胞透過性ペプチド(CPP)を介した送達を測定するためにこれまで応用されてきたが、植物細胞へのバイオカーゴの送達を確認するために採用されたことはなかった。
CPPは小さな陽イオン性または両親媒性ペプチドで、カーゴに結合させると細胞質への送達が可能になる。
われわれがDCIPのテストにCPPを利用したのは、その合成のしやすさ、植物に合わせた送達スキームにおけるこれまでの展開、また、植物におけるその基本的な細胞透過メカニズムについては、まだ未解明であるためである。
その結果、DCIPは共焦点イメージングにより10μM程度のGFP11ペプチドの送達を確認することができ、300μMのCPP送達GFP11で葉細胞へのほぼ包括的な送達(78%以上)が達成されることを示した。
さらに、DCIPを用いて、植物におけるタンパク質送達を達成するためのいくつかの一般的なCPP(TAT、R9、BP100)の相対的な有効性を定量化し、葉におけるR9を介した送達がエンドサイトーシスにほとんど依存しないことを明らかにした。
また、DCIPを用いて葉の組織におけるR9-GFP11の安定性を調べ、24時間以内に組織局在GFP11とGFP相補シグナルが消失することを示した。
最後に、DCIPを利用して、CPPを介したいくつかのリコンビナントタンパクの、中葉細胞および葉肉細胞の細胞質への送達を実証した。
また、コンセプトの実証として、CPPを用いた送達が生きた植物において新規なタンパク質間相互作用を形成するために使用できることを示し、シロイヌナズナWUSCHEL転写因子の送達を実証することで、送達されたタンパク質やペプチドを用いた植物の生理学的工学の可能性を示した。
図1 DCIPによるペプチド送達のデモンストレーション。
a DCIPのワークフロー概略図(BioRender.comで作成)。
(i) N. benthamianaをDCIPベクターでアグロインフィルトレーションする。
(ii) 3d.p.i.の植物に、GFP11に融合したペプチドまたはタンパク質カーゴを浸潤させる。
(iii)培養中、GFP11は植物細胞に内在化される。
細胞質への導入が起こると、GFP11はGFP1-10を相補し、sfGFP蛍光が回復する。(iv) インキュベーション後、葉ディスクを
mCherry蛍光を用いて蛍光核から細胞を同定し、Cell Profilerを用いて画像化・解析する。(v) sfGFP蛍光をmCherry蛍光に正規化する。
DCIP発現のばらつきを考慮するため、sfGFP蛍光をmCherry蛍光で正規化し、mCherry陽性細胞の総数に対するGFP陽性細胞の数を求める。
mCherry陽性細胞の総数に対するGFP陽性細胞の数を送達効率のアナログとして決定した。
b DCIPを発現している葉ディスクの代表的な最大強度投影図。
sfGFP蛍光は緑色(左)、mCherry蛍光との2色オーバーレイはマゼンタ色(右)、mCherry発現細胞は、自動画像解析に適した小さな丸い蛍光体として核を持つ。
直交投影は、葉のイメージング深度を示している。
100μMのR9-GFP11で4時間処理した後のDCIP発現葉の等価画像。スケールバーは100μmを表す。
図6 植物中で形成されるF-アクチン送達を介したタンパク質-タンパク質相互作用。
a 精製した組換え発現GFP11-Lifeact-R9(9.9 kDa)を用いたデリバリーを介したタンパク質-タンパク質相互作用の模式図。
浸潤したGFP11-Lifeact-R9はCPP仲介輸送により細胞質に入り、植物細胞内のf-アクチンフィラメントに結合し、mCherry-sfGFP1-10をアクチンフィラメントに足場することで、タンパク質間相互作用を媒介する。
b cytoDCIPと送達されたGFP11-Lifeact-R9によって可能になったアクチン標識の代表的な標準偏差投影FOV。CytoDCIP発現葉に120μM GFP11-Lifeact-R9を浸潤させ、リーフディスクとして6時間インキュベートした。
c 細かいフィラメントの詳細を示す挿入図(白四角)。
d フィラメントは、cytoDCIP足場形成の結果、mCherryと共局在するsfGFP蛍光構造鎖として現れる。
e 120μMのR9-GFP11を用いたCytoDCIP発現葉の対照処理では、mCherryとsfGFPの両方の拡散した細胞質局在が見られた。
f GFP11-Lifeact-R9を25μMラトルンクリンBで共処理すると、細胞質染色の拡散のみでアクチンの脱重合が起こる。
すべての画像において、mCherryはマゼンタ色、sfGFPは緑色に擬似着色されている。フルFOVスケールバーは100μm、挿入図は20μm。
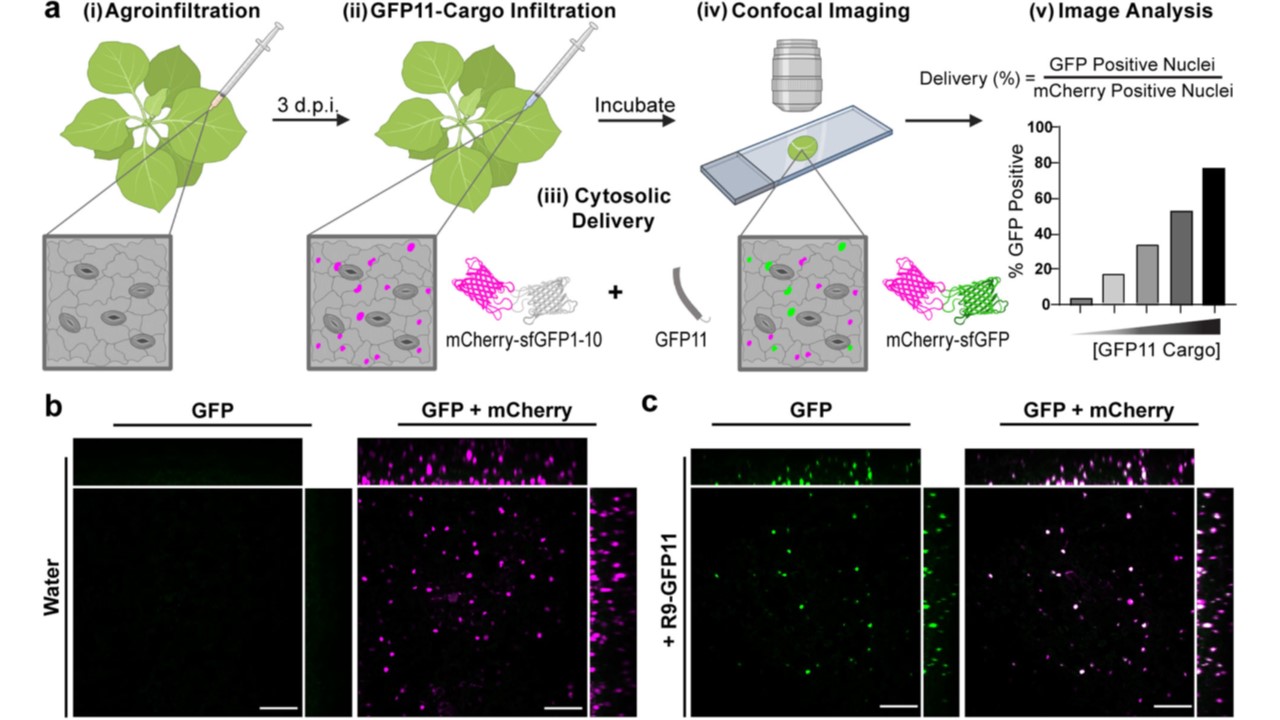
図1
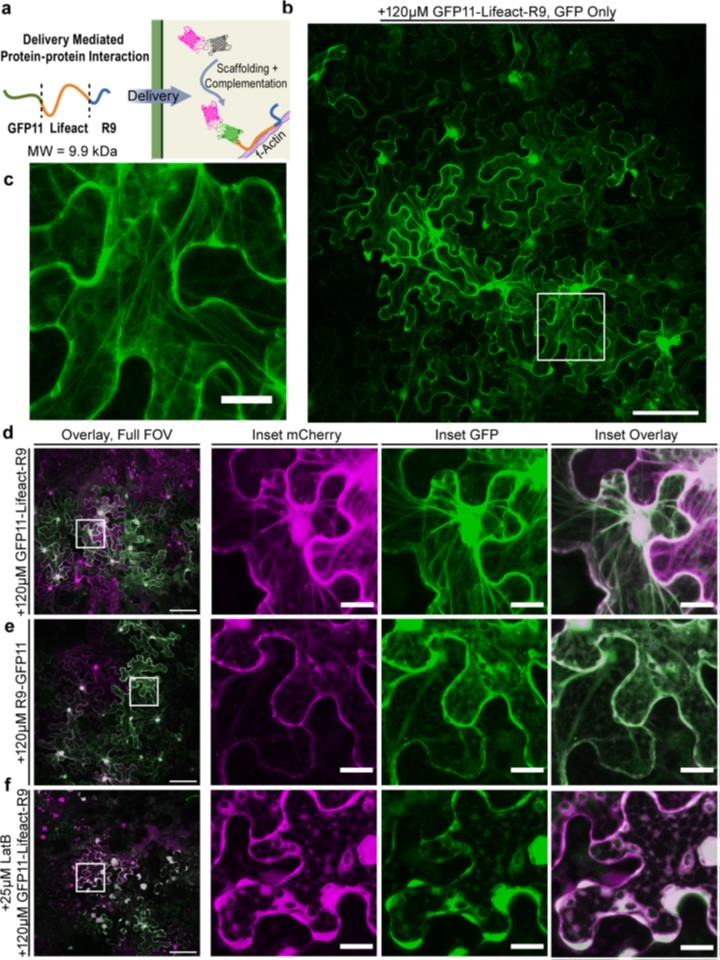
図6