エピゲノム編集によるキャッサバ細菌病耐性の向上
以下は。ゲノム編集でエピゲノムを操作したらキャッサバの耐病性が向上したというものです。エピゲノム変異育種を狙ったものですが、まだまだ何世代まで安定した高い遺伝率を誇るかに関しては未知です。
この論文の解説文に関してはすでに、以下に訳して紹介してあります。
研究者らが作物改良のための新しいエピジェネティック編集技術を発表
Date: 2023-02-25 (Sat)
エピゲノム編集によるキャッサバ細菌病耐性の向上
Improving cassava bacterial blight resistance by editing the epigenome
KiraM. Veley 1, Kiona Elliott1,2, Greg Jensen1, Zhenhui Zhong 3, Suhua Feng3,4,Marisa Yoder1, Kerrigan B. Gilbert 1, Jeffrey C. Berry 1, Zuh-Jyh Daniel Lin1,Basudev Ghoshal, Javier Gallego-Bartolomé, Joanna Norton,
Sharon Motomura-Wages, James C. Carrington,Steven E. Jacobsen & Rebecca S. Bart
Nature Communications | ( 2023)1 4:85
(要旨)
病原菌は宿主の感受性(S)遺伝子の発現を利用して、感染や発病を促進する。
DNAメチル化は遺伝子発現に影響を与えるエピジェネティックな修飾であるため、標的メチル化によってS遺伝子へのアクセスを遮断することで、病害抵抗性を高めることができると考えられる。
キャッサバ細菌病の原因菌であるXanthomonas phaseoli pv. manihotisは、transcription activatorlike20(TAL20)を用いてS遺伝子MeSWEET10aの発現を誘導している。
本研究では、RNA指向性DNAメチル化経路の構成要素と融合した合成ジンクフィンガーDNA結合ドメインを用いて、MeSWEET10aプロモーター内のTAL20エフェクター結合要素にメチル化を誘導することに成功した。
このメチル化はTAL20の結合を妨げ、in vivoでのMeSWEET10aの転写活性化をブロックし、これらの植物が正常な成長と発達を維持しながらCBB症状の減少を示すことを実証した。
したがって、本研究は、作物改良に有用なエピゲノム編集アプローチを提示するものである。
(まえがき)
感受性(S)遺伝子は、様々な病原体が共通して利用するメカニズムであるため、宿主のゲノム内に存在するとお荷物となる。
しかし、これらの遺伝子は植物の正常な成長や生殖発生に必要な遺伝子であるため、変異させると悪影響を及ぼす可能性がある。
多くの場合、病原体は感染時にS遺伝子の発現を積極的に上昇させる。
Xanthomonas属やRalstonia属の植物病原細菌は、転写活性化因子様(TAL)エフェクターを発現し、宿主ゲノム内の特定の、主に予測可能なプロモーター配列(エフェクター結合要素、EBE)を認識・結合することによって、S遺伝子の転写を活性化する。
これまでの研究で、遺伝子編集を行うことで病原体によるS遺伝子の利用を防ぐことができ、その結果、耐性が向上することが実証されている。
また、エピゲノム修飾は遺伝子発現に影響を与えることができる。
TALの結合はDNAのメチル化によって阻害されるため、TALエフェクターの結合部位にメチル化を狙えば、S遺伝子の誘導が阻害され、病徴の減少によって計測されるように抵抗性が高まるという仮説を立てた。
真核生物において、シトシンのDNAメチル化はエピジェネティックな遺伝子制御の重要なメカニズムである。
植物では、RNA-directed DNA methylation (RdDM) 経路が新規な5-メチルシトシンメチル化の確立に関与している。
これまでの標的メチル化研究では、開花時期に影響を与えるシロイヌナズナの自然発生エピ対立遺伝子を利用していた。
これらの研究では、CRISPR-Cas9ベースのツールと、RdDMに関与する植物のメチル基転移酵素DOMAINS REARRANGED METHYLTRANSFERASE 2(DRM2)の触媒ドメインまたは細菌のCGメチル基転移酵素MQ1というメチル化経路の構成要素を組み合わせて使用していた。
さらに、DRM2やDEFECTIVE IN MERISTEMSILENCING 3(DMS3)など、多くのRdDMタンパク質が人工的なジンクフィンガー(ZF)と融合することでメチル化標的として有効であり、このタンパク質はシロイヌナズナのRNA polymerase Vがクロマチンに結合してRdDMを誘発する標的タンパク質であった。
CRISPRベースのツールは特異性が高いが、ZFベースのターゲティングシステムは、一般的に小さな導入遺伝子を必要とし、PAM部位の位置に制約されないため、一部のアプリケーションに適している。
キャッサバ細菌病(Cassavabacterial blightCBB)はXanthomonas phaseoli pv. manihotis(Xam、別名:Xanthomonas axonopodis pv. manihotis)によって引き起こされ、キャッサバ(Manihot esculenta Crantz)が栽培されているすべての地域で発生する。
近年、Xam27の特定の株に対してある程度の耐性を示す抵抗性遺伝子が報告されたが、現在のところ育種家が利用できる強力な広域抵抗性遺伝子は存在しない。
感染すると、葉に濃い緑色の角ばった水浸状の病斑ができ(図1A)、その後Xamが通同組織を移動し、葉がしおれ、最終的には植物が枯れる。
Xamは複数のTALエフェクターを含む20〜30種類のエフェクターをキャッサバ細胞内に分泌する。
我々は、これらのTALエフェクターの1つであるTAL20が、この病原体の主要な病原性決定因子であることを以前に明らかにした。
TAL20は、SWEET(Sugars Willually be Exported Transporters)ファミリーの糖輸送体であるMeSWEET10aの異所的なS遺伝子発現を誘導する。
感染時のMeSWEET10aの発現は、水浸性表現型と完全な病原性に必要である。
野生型キャッサバでは、MeSWEET10aのプロモーターはメチル化されていない。
そこで、TAL20 EBEをターゲットとしたメチル化により、MeSWEET10aの異所性発現を防ぎ、CBBに対する抵抗性を付与できると考えた(Fig. 1B)。
このように、作物改良のための有用なアプローチとしてエピジェネティック編集を紹介する。
我々は、DMS3と融合したZFを用いて、MeSWEET10aプロモーター内のTAL20 EBEにDNAメチル化を誘導することを示した。
シトシンのメチル化は、EBEへのTAL20の結合を阻害し、MeSWEET10aの転写活性化を防止することを実証しキャッサバ植物における細菌感染症の症状を減少させることを示した。
(考察)
要約すると、我々は、人工ZFと組み合わせたDMS3が、MeSWEET10aのEBEにおけるメチル化の標的、de novo確立を引き起こし、TAL20が誘発するMeSWEET10aの異所的発現をブロックし、CBB病症状の減少につながったことを示している。
キャッサバは通常クローン増殖させるが、本研究の期間中(組織培養と温室で3-4年維持)、経時的にメチル化をモニターした。
我々は、クローン繁殖による導入遺伝子の存在下で、メチル化は安定していると結論付けた。
今回紹介した技術の構成要素はキャッサバ由来ではないため(シロイヌナズナDMS3と合成ジンクフィンガーの組み合わせ)、このアプローチは他の作物種でも同様に成功する可能性があると仮定するのは妥当であろう。
ゲノム編集は、今回紹介した研究と同様の結果を得ることができる既存の強力な戦略であり、今後も多くの用途で好まれるアプローチになると思われる。
同時に、標的メチル化技術の成熟が進めば、それが好ましいとされるケースも出てくる可能性がある。
例えば、DNAメチル化は、オン/オフのスイッチとは対照的に、遺伝子発現の羅針盤(ダイヤル)として適用されるかもしれない。
同様に、DNAメチル化はDNA配列を変化させないので、DNAメチル化の変化を利用して、組織または環境に特異的な方法で発現パターンを実現することが可能かもしれない。
これは、組織や環境に特異的なプロモーターを用いてメチル化試薬を駆動することにより、トランスジェニック植物で実現できるかもしれない。
また、近い将来の重要な目標は、標的遺伝子非存在下でのDNAメチル化の遺伝率を研究することである。
新規メチル化領域の大きさ、メチル化のタイプ(CG、CHG、CHH)、ゲノム内の特定の位置はすべて遺伝率に影響すると思われる。
これらの要因はそれぞれ調査する必要があり、目的の作物でこの研究を進めることには価値があるが、モデル系を使って多くのことが学べると期待される。
最終的には、この戦略の実用性は、エピジェネティックな編集の遺伝率と安定性によって決定されるであろうし、これは用途やターゲットに特有のものであると思われる。
いずれにしても、ここで示された遺伝子組み換えエピジェネティックアプローチは、他の様々な作物改良プログラムにおいても有用であると思われる。
以下、紙面の都合で、Fig1,Fig2,Fig4 の訳注を示します。
図1|エピジェネティック修飾を利用した病害抵抗性向上戦略の概要。
A 左:CBBに感染したキャッサバの例(ウガンダ、2019年)。
右:左の葉から選択した領域、水浸性領域を白い矢印で示す。
B エピジェネティックCBB病抵抗性の図解 戦略。
上:WT植物では、Xam由来のTAL20は、S遺伝子MeSWEET10aのプロモーターに存在する特定の配列(EBE)に結合する。
結合すると、TAL20は病害の成立に必要である糖トランスポーターであるMeSWEET10aの異所性発現を誘導する。
右は典型的な「水浸性」病斑で、CBBの初期指標である。
下:DNAメチル化により、TAL20がEBEに結合するのを阻害している。
MeSWEET10aの発現は誘導されず、病気の症状は軽減される。
図2|DMS3-ZFの発現により、in vivoでEBEにCGメチル化が起こる。
A 2つの独立したトランスジェニック系統(133および204)およびZFのみのネガテイブ対照系統(216)からの個々の植物におけるトランスジーンの発現。
各サンプルのキャッサバ品種情報は、レーンの上に記載されている。
最初の 2行目:ZFの発現を示す代表的なウェスタンブロット(抗FLAG)。(ZF-3xFLAG)タンパク質の発現を示す代表的なウェスタンブロット(上)およびDMS3なし(中)。
関連するサイズ標準 は右側に示されている(kD)。
下。Coomassie Brilliant Blueで染色した Rubisco、ローディングコントロール。
B (A)に示したサンプルの代表的なPCRベースのバイサルファイトシーケンス(ampBS-seq)の結果。
上:メチル化について評価したMeSWEET10a プロモーター領域のメチル化を評価したグラフ。
EBE(灰色)、推定されるTATAボックス (青)およびZF結合部位(オレンジ)が示されている。
予測される5′UTRと MeSWEET10a転写開始部位は、緑色で示されている。
点線の枠内の領域(233bp)はampBS-seqに供された。
下図。CG、CHG、およびCHH MeSWEET10aプロモーター(EBE、灰色)のDNAメチル化レベル(パーセント、y軸)をDMS3-ZFを添加した場合と添加しない場合のampBS-seqで測定した。
各プロットの組織の背景は右側に示した。500リード以上のシトシンがメチル化されている場合をマッピングした。6つの独立した実験の代表例である。
C 代表的な野生型 (TME419)および(D)DMS3-ZF発現植物(ライン#133)の代表例。
スケールバー=14cm。
図4|キャッサバのCBB病表現型に対するメチル化の影響。
A RT-qPCRによって決定されたWTおよびトランスジェニックラインにおける正規化MeSWEET10a発現(y軸、log10スケール)。
キャッサバ遺伝子GTPb (Manes.09G086600) およびPP2A4 (Manes.09G039900) を内部コントロールとして使用した。
ボックスは、Xanthomonas処理によって色分けされている。各バックグラウンド(x軸)に含まれる生物学的複製(黒点)は以下の通り:n=4, 9, 4, 5, 10は4回の独立した実験にわたって調べた。
各バックグラウンドの各処理群に含まれるnは一貫している。
箱内の水平黒線は中央値を示し、箱の限界値は中央値を示す。
ひげは、25%および75%から四分位範囲(1.5×IQR)の1.5倍を示す。
両側Welchのt検定のp値はプロット内の括弧の上に記載されている。
B TME419WT の葉の浸水表現型の代表的な画像。
DMS3-ZF発現植物の葉の浸水表現型の代表的画像。
Xam668(XamWT)またはXam668 TAL20欠失変異体(XamΔTAL20)感染後4日目に撮影した画像。スケールバー=0.5 cm。
C 浸透後4日目のXam浸潤葉(背景、x軸)の画像から水浸の観察面積(ピクセル、y軸)。
p値(Kolmogorov-Smirnov検定)は、プロット内の括弧の上に示した。
D (C)で測定した領域の浸水表現型の強度(y軸)。
同じ葉内の模擬処理サンプルの平均値に対する浸水領域の負の平均グレースケール値を報告する(詳細は方法を参照)。
計算されたp値(両側Kolmogorov-Smirnov検定)はプロット内の括弧の上に示されている。
両ボックスプロット。各バックグラウンド(x軸)に含まれる生物学的複製(黒点)は以下の通り:n = 24, 30, 24, 24, 24は、3つの独立した実験にわたって調べた。
箱内の水平黒線は中央値を示し、箱の限界はRソフトウェアで決定された25番目と75番目のパーセンタイルを示す。
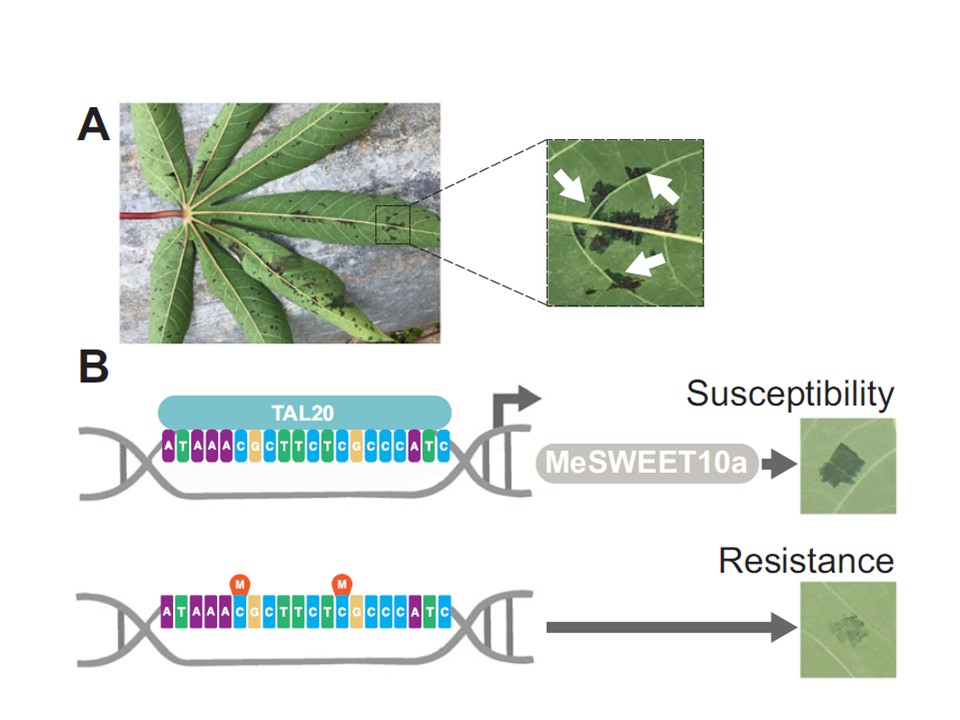
Fig1
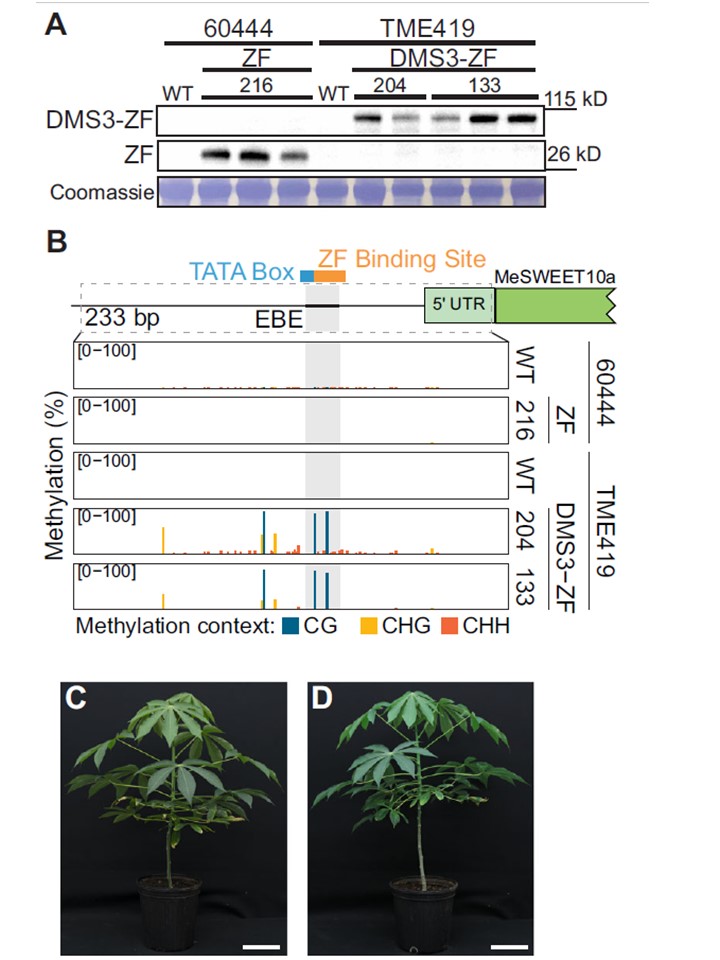
Fig2
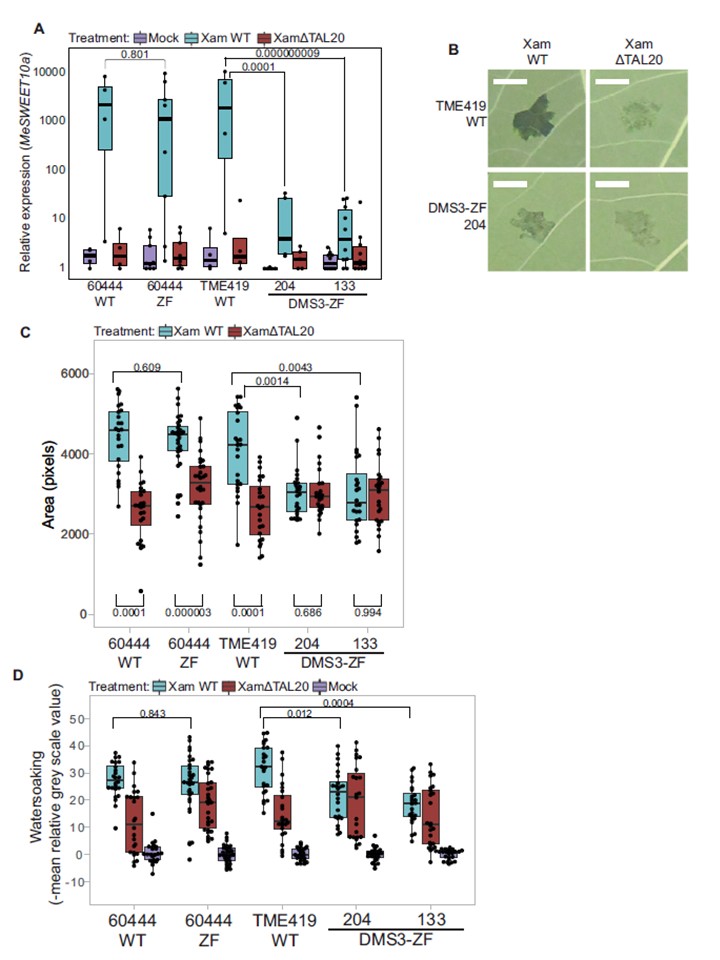
Fig4