Pseudomonas aeruginosa(緑膿菌)が鉄にアクセスする複数の戦略
ここでは小生がこの論文で提示されている多くのそれぞれのシデロフォアの取り込み機構モデルのうち、植物にも多少関係すると思われる「クエン酸鉄」と「ヘム鉄」の吸収機構についてのみ紹介する。
Pseudomonas aeruginosa(緑膿菌)が鉄にアクセスする複数の戦略
Pseudomonas aeruginosa and its multiple strategies to
access iron
イザベル・J・シャルク1,2|クェンティン・ペロー1,2
(概要)
Pseudomonas aeruginosa(緑膿菌)は、多くの自然環境および人工環境に存在するユビキタスな細菌である。
また、植物、動物、ヒトの病原体でもある。
ほとんどの生物同様に、鉄は緑膿菌の増殖に不可欠な栄養素である。
緑膿菌は、多様な自然環境および宿主環境において生き残るために、鉄にアクセスし、そのホメオスタシスを維持するための複雑なシステムを進化させてきた。
P. aeruginosaは、鉄を利用するために、2種類のシデロフォア(ピオベルジン、ピオシェリン)を生産することができる。また、他の細菌が生産する様々なシデロフォア(マイコバクチン、エンテロバクチン、フェリオキサミン、フェリクロム、ビブリオバクチン、エアロバクチン、リゾバクチン、シゾキニン)なども利用することが可能である。
さらに、カテコールアミン神経伝達物質や植物由来のモノカテコールに加え、クエン酸をシデロフォアとして利用することも可能である。
また、 P. aeruginosaゲノムには、3つのヘム取り込み経路(ヘムは鉄源)と1つの鉄獲得経路がコードされている。
本総説は、 P. aeruginosaが用いるすべての鉄およびヘム獲得経路に関わる分子機構に関する現在の知見を要約する
ここでは小生が下図多くのそれぞれのシデロフォアの取り込み機構のうち、植物に関係すると思われるクエン酸鉄とヘム鉄の吸収機構についてのみ紹介する。
(図1の説明):クエン酸依存の鉄分取り込み経路
緑膿菌はクエン酸をエキソシドフォアとして利用することができる(Marshall et al.,2009)。
クエン酸第二鉄複合体は、TBDTであるFecA(PA4825)によって認識され、ペリプラスムに輸送される。
クエン酸第二鉄複合体は、溶液中の平衡状態で共存する、化学量論的に様々な複合体のかなり大きなカテゴリーを表している。
これらの錯体は、金属との結合に水分子が関与していることもあり、重合することも可能である。
従って、TBDT FecAが認識する第二鉄-クエン酸複合体の化学量論を決定することは困難であるが、文献的には第二鉄-ジクレート型が認識されることが当然とされているようである。
fecAの転写は、シグマペアECF/アンチシグマFecI/FecRによって制御されている。
ペリプラズムに入ると、ペリプラズムのフェレドキシンPcoAによる鉄の還元を伴うメカニズムで、鉄-クエン酸複合体が解離すると考えられている。
第一鉄のみが内膜のFeoABを経由して内膜を移動する。
(図2の説明):ヘムの摂取
現在、緑膿菌では、Phu(Pseudomonas heme uptake)、Has(heme-acquisition system)、PA1300-1302系(Smith & Wilks, 2015)という3つのヘム獲得系が記載されている。
PA1302は、HxuCとしても知られるTBDTをコードすると予測される遺伝子で、最近HxuAと改名され、このトランスポーターを取り巻く混乱に拍車をかけている。
PhuおよびHas系は非常によく特徴付けられているのに対し、ヘムTBDT内のPA1302の分類はまだ不明である。
Hxuは、遊離ヘムの輸入に関与するHaemophilus influenzaeのHxuCトランスポーターとの強い相同性に基づいて、ヘムTBDTとして最初に特定された。
最近の研究によると、HxuAは高濃度(20μM)のヘム存在下で過剰生産され、HxuAの転写はシグマ/アンチシグマ因子対をコードするHxuIとHxuRの制御下にあると推測されている。
緑膿菌のヘムホメオスタシスにおけるHxuAの役割に関するデータは、代わりに、輸送の役割よりもむしろシグナリングの役割を示す傾向にある。
Phuシステムは、遊離ヘムを細菌ペリプラスムに輸入することができるTBDT PhuRと、オペロンphuSTUVWによってコードされるタンパク質で構成されている。
phuRは鉄分不足の条件下で過剰発現するが、その転写制御系はまだ特定されていない。
ヘムはPhuRによってペリプラスムに取り込まれると、ペリプラスム結合タンパク質PhuTに結合し、内膜ABCトランスポーターPhuUVに運ばれる。
細胞質に入ると、ヘムはPhuSタンパク質に結合する。HemOはPhuS-ヘム複合体と相互作用し、外因性のヘムをビリベルジンIXßとビリベルジンIXδに分解する。
細胞内にßおよびδビリベルジンが存在しないと、Has系のヘモフォアHasApの細胞外濃度が低下することから、ßおよびδビリベルジンの制御的役割が示唆される。
phuWが発現するタンパク質の役割や局在は現在のところ不明であるが、この遺伝子はヘム獲得に関与するリポタンパク質ファミリーの仮説であるChaN様タンパク質をコードするものと予測されている。
Hasシステムは、HasApヘモフォアという、環境からヘムを捕捉し、TBDT HasRによって認識される小さな分泌タンパク質を含むという点で非常に珍しい。
外膜レベルでのこの相互作用により、ヘムがペリプラズムに移動し、そこでPhuTに結合してPhu経路に加わる。
Phu系とは異なり、Has系はシグマ/アンチシグマ因子HasI/HasSによって制御されている。HasApの細胞外環境への分泌は、HasEDOpmM排出系に依存している。
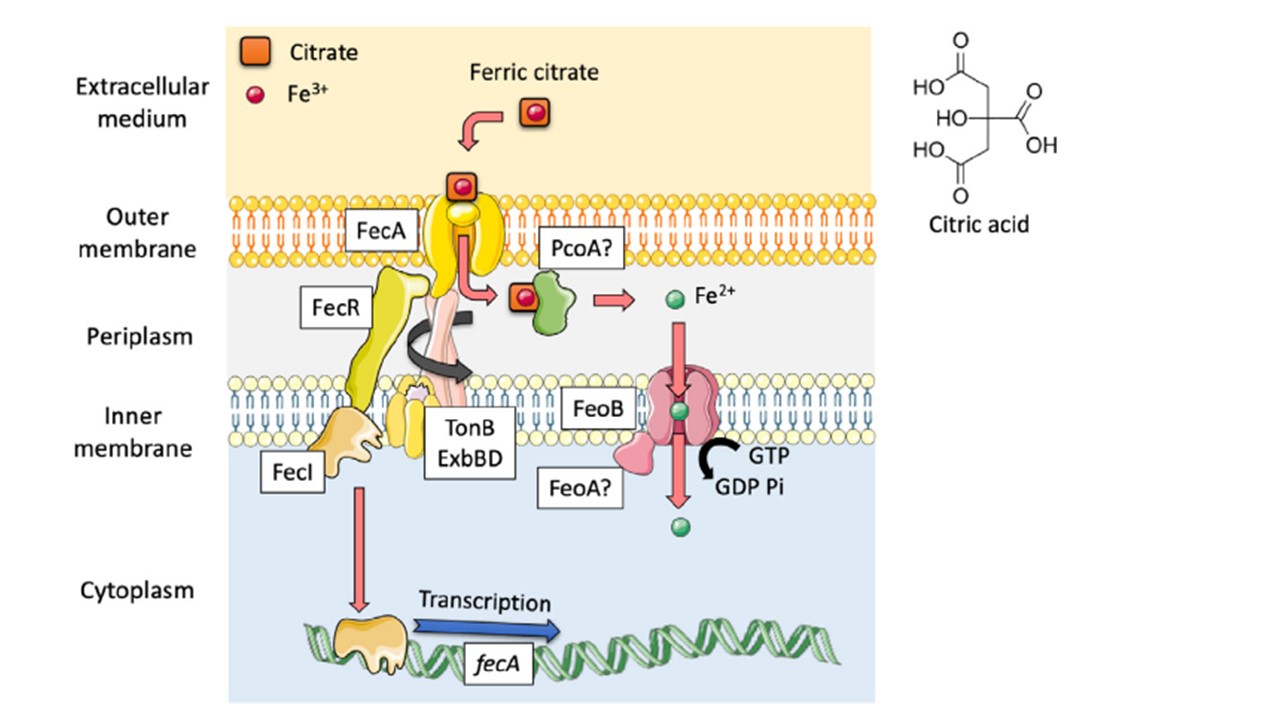
図1:「クエン酸鉄」吸収モデル
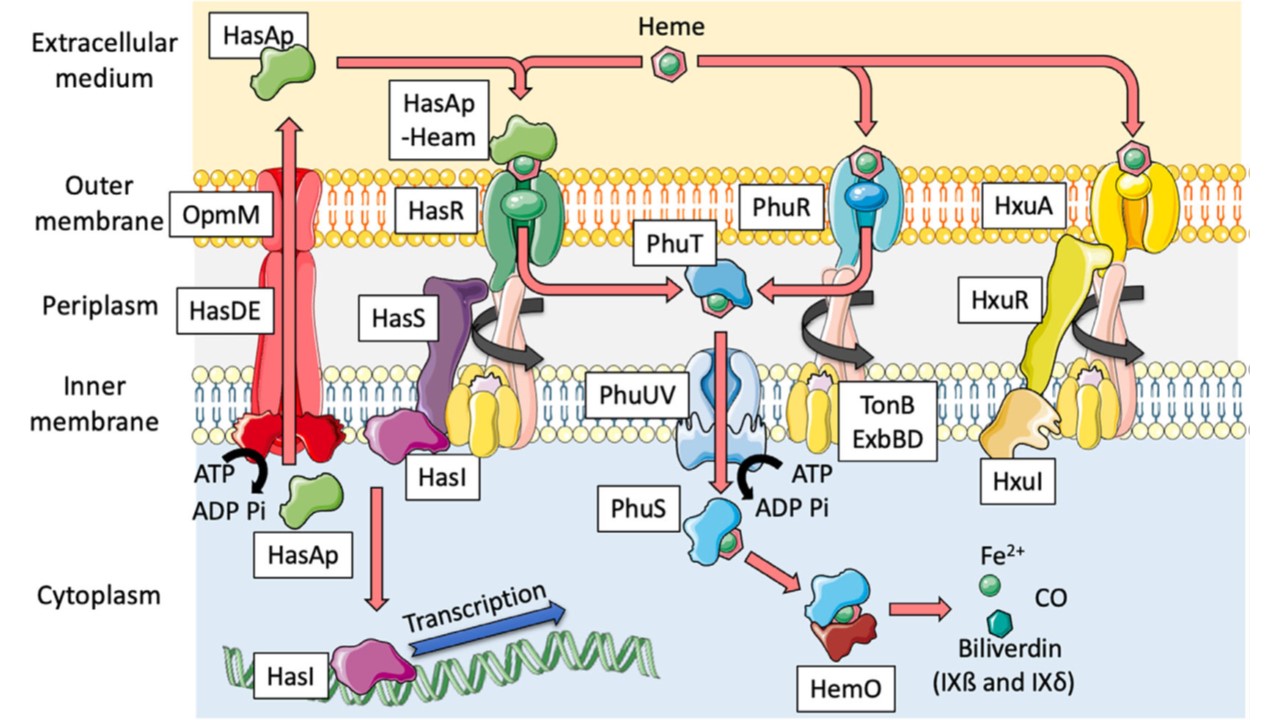
図2:「ヘム鉄」吸収モデル