FE UPTAKE INDUCING PEPTIDE1は、シロイヌナズナの維管束梢における鉄欠乏応答遺伝子を制御することにより、鉄の転流を維持する
FE UPTAKE INDUCING PEPTIDE1は、シロイヌナズナの維管束梢における鉄欠乏応答遺伝子を制御することにより、鉄の転流を維持する
FE UPTAKE INDUCING PEPTIDE1 maintains Fe translocation by controlling Fe deficiency response genes in the vascular tissue of Arabidopsis
Satoshi Okada1 | Gui J. Lei2 | Naoki Yamaji2 | Sheng Huang2 | Jian F. Ma2 |
Keiichi Mochida3,4,5,6,7 | Takashi Hirayama1,3
1Group of Environmental Stress Response Systems, Institute of Plant Science and Resources, Okayama University, Okayama, Japan
2Group of Plant Stress Physiology, Institute of Plant Science and Resources, Okayama University, Okayama, Japan
3Crop Design Research Team, Institute of Plant Science and Resources, Okayama University, Okayama, Japan
4RIKEN Center for Sustainable Resource Science, Yokohama, Kanagawa, Japan
5Kihara Institute for Biological Research, Yokohama City University, Yokohama, Kanagawa, Japan
6Microalgae Production Control Technology Laboratory, RIKEN Baton Zone Program, RIKEN Cluster for Science, Technology and Innovation Hub, Yokohama, Japan
7School of Information and Data Sciences, Nagasaki University, Nagasaki, Japan
Plant Cell Environ. 2022;45:3322–3337.
(概要)
FE UPTAKE-INDUCING PEPTIDE1 (FEP1) は、IRON MAN3 (IMA3) とも呼ばれ、シロイヌナズナの鉄欠乏反応に関与する短いペプチドである。
最近の研究により、その分子機能が明らかにされたが、全身の鉄欠乏反応における生理的な機能は完全には解明されていない。
そこで、FEP1 欠損変異体 fep1-1 および FEP1 をエストロゲン誘導的に発現させたトランスジェニック株を用いて、鉄ホメオスタシスにおける FEP1 の生理的機能を探るため、トランスクリプトーム解析を実施し た。
その結果、FEP1はいくつかの鉄欠乏応答性遺伝子を特異的に制御しており、FEP1が根における鉄の取り込みではなく、鉄の転流に関与していることが明らかとなった。
鉄欠乏条件下での木部樹液中の鉄濃度は、野生型(WT)と比較して、fep1-1変異体では低く、FEP1誘導型遺伝子導入植物では高くなった。
Perls染色では、根の総鉄量は両遺伝子型とも同程度であったが、fep1-1根の皮相にはWT根よりも大きな鉄の蓄積が見られた。
さらに、fep1-1変異体は、オリゴペプチドトランスポーター3-2(opt3-2)変異体の葉における鉄過剰蓄積表現型を部分的に抑制していた。
これらのデータは、FEP1がシロイヌナズナの維管束における鉄の移動と鉄量の維持に極めて重要な役割を担っていることを示唆している。
以下考察が力作なので全文を訳した。
(考察)
FEP1 の生理的役割を理解するために、FEP1 欠損株と機能獲得株のトランスクリプトームを解析した。その結果、fep1-1 変異は、鉄欠乏条件下でもシュートにおいて、ここでは FEP1 サブネットワーク遺伝子と呼ばれる明確な遺伝子群を活性化することが分かった。
FEP1サブネットワーク遺伝子をSchwarzとBauerが報告した遺伝子共発現ネットワークと比較したところ、FEP1サブネットワーク遺伝子は、Ib bHLHをコードする遺伝子を含むFIT非依存性遺伝子で構成されていると考えられるクラスターのメンバーと大きく重なっていることが分かった。
このことから、他の鉄欠乏応答性遺伝子の発現上昇は、主にFITとIb bHLHsによって制御されていることが示唆された。
しかし、FIT 依存性遺伝子とされる IRT1 と FRO2 の発現量は、fep1-1 では WT に比べて変化しないか、あるいは低下していた。
FEP1 の出力調節によるこれらの効果は、FEP1 が鉄欠乏反応においてユニークな役割を果た していることを実証した。
FEP/IMAペプチドは、E3リガーゼBTSおよびBTSLsを介してIVc bHLH転写因子の分解を制御する。
これらのbHLHをコードする遺伝子は、Fe欠乏応答性遺伝子の遺伝子制御ネットワークの上位に位置するため、物理的相互作用によるBTS/BTSLを介した分解がFeホメオスタシスにおいて重要なステップであると考えられる。
提案されたモデルでは、FEP/IMAペプチドがBTS/BTSLと競合してこれらのbHLHに結合し、結果として安定化させるというものである。
これらのIVc bHLHのうち少なくとも2つ、bHLH105とbHLH115は、FEP1とBTSの発現を活性化し、正と負のフィードバックループを形成している。
したがって、細胞内の鉄量、BTS量、FEP/IMAペプチド量、IVc bHLH量のバランスが、鉄欠乏反応を決定する。
このモデルは、鉄欠乏応答性遺伝子の制御に関わる遺伝子の一過性発現系、機能喪失株、機能獲得株を用いたin vitroまたはin vivoアッセイの結果とほぼ一致する。
このモデルでは、シロイヌナズナの 6 種類の FEP/IMA ペプチドが IVc bHLH 上の BTS 結合部位を競合することで、 IVc bHLH と BTS/BTSL との相互作用を阻害していることがわかった。
本研究では、シュートにおけるFEP1の発現はFEP2やFEP3よりも高かったが、根においてはFEP2やFEP3の発現と比較して低かった。
したがって、少なくとも根においては、1つのFEP/IMAペプチドの損失は、他のFEP/IMAペプチドによって補われる可能性がある。
しかし、fep1-1の根と芽では、FEP1サブネットワーク遺伝子が活性化されている。
FEP1が2つのIVc bHLHの直接の標的であるというユニークな機能が、このfep1-1の表現型を引き起こしている可能性がある。
このモデルによれば、FEP1 の機能欠損は IVc bHLH を不安定にすることで、鉄欠乏応答性遺伝子をダウンレギュレートすると考えられる。
しかし、我々は、fep1-1変異体の芽と根において、これらの遺伝子が発現上昇することを明らかにした。
これは、IVc bHLHs が低下すると細胞や組織で鉄欠乏が起こり、鉄欠乏応答性遺伝子が活性化されるという、鉄欠乏応答の二次的作用で説明できるかもしれない。
fep1-1のシュートのFe量はWTのシュートよりも低かったが、fep1-1の根のFe量は変化しなかった、Fe欠乏応答性遺伝子の発現が活性化していた。
また、WTと比較して、fep1 opt3のシュートではbHLH39の発現が有意に高く、より多くのFeを蓄積していた。
今回のトランスクリプトームの結果を説明するためには、鉄欠乏応答性遺伝子の制御に関与するさらな る因子を考慮する必要があるのかもしれない。
重要なことは、実験条件が鉄欠乏応答遺伝子の発現に影響を与えることである。
我々の以前の研究では、水耕栽培したfep1-1植物の根ではbHLH38とbHLH39遺伝子が活性化されていたが、Fe不足の条件下でMS培地で栽培したfep1-1植物の根では活性化されていなかった。
このことは、植物を水耕栽培した今回の研究において、fep1-1の根でこれらの遺伝子の発現量が変化しなかった理由を説明することができる。
さらに、Liらは、プレート培地で栽培したima3/fep1変異体の根では、これらの遺伝子の発現レベルが活性化しないことを示した。
あるいは、FEP1は組織または細胞系譜特異的に機能している可能性もある。
FEP1は、師管伴細胞で高発現している。
我々は、FEP1pro:FEP1-GFP株を用いた本研究(図6)およびFEP1pro:GUS株を用いた先行研究において、FEP1が維管束組織で優先的に発現していることを明らかにした。
さらに、BTSを含むFEP1-サブネットワーク遺伝子の転写物は、伴細胞のトランスクリプトームにおいて濃縮されていた。
興味深いことに、4つのIVc bHLH遺伝子とbHLH121はすべて師管伴細胞で高発現していた。
対照的に、FITおよびIb bHLH遺伝子の発現は、これらの細胞ではそれほど高くはなかった。
Liらによって示されたIVc bHLHによるFEP1およびBTSの優先的な活性化も、FEP1およびBTSの組織特異的発現によって説明できる。
これらのデータは、FEP1が伴細胞を含む師管組織において優先的にその標的遺伝子を制御していること、そしてfep1-1変異が鉄欠乏条件下で局所的な鉄欠乏をもたらすことを示唆するものであった。
この考えは、我々の生理学的研究の結果からも支持される。
導管液の Fe 濃度は、Fe 欠損の fep1-1 では WT や opt3-2 よりも低く、これは fep1-1 では導管への Fe 転移が損なわれていることを示している。
この考えと一致するように、Perls染色により、fep1-1の根では皮層中心柱への鉄の移動が損なわれていることが明らかになった。
このことから、fep1-1 では IVc bHLH タンパク質の安定性が低いため、大脳皮質から茎への鉄輸送に関与する遺伝子を含む鉄欠乏応答性遺伝子の発現が低下しているのではないかと考えら れる。
fep1-1では皮層から中心柱へのFe転流が少ないため、導管を含む維管束組織でFe欠乏が課され、これらの組織でFe欠乏応答性遺伝子が活性化されると考えられる。
FEP1の機能獲得による影響を調べるために、FEP1の構成的な異所性発現が重度の成長遅延を引き起こすことから、エストロゲン誘導系を用いた。
このエストロゲン誘導系では、FEP1の異所性発現は時間的に制御されているが、ユビキタスである。
FEP1は特定の細胞や組織で機能するため、この系から得られたトランスクリプトームデータは、FEP1の異所性発現に起因する可能性のある二次的影響を考慮する必要があります。
しかし、トランスクリプトームデータは、地上部と根におけるFEP1誘導の異なる効果について有用な手がかりを与えてくれる。
FEP/IMA のワーキングモデルによると、高レベルの FEP1 は IVc bHLH を安定化させ、鉄欠乏応答性遺伝子と鉄の取り込みをアップレギュレートする。
FEP1の異所性発現は導管液中のFe濃度を上昇させ、地上部および根におけるより高いFe蓄積を誘導した。
しかし、FEP1誘導に伴い、bHLH39の発現は地上部で誘導されなかった。
おそらく、十分なまたは過剰なFeは、FEP1の異所性発現によって誘導される遺伝子の活性化の程度を、地上部では調節するが、根では調節しないのであろうと思われる。
より高いFeレベルは、植物体内でBTSを不安定にするが、BTSがFe不足条件下でFe欠乏反応を抑制する分子機構は、十分に解明されていない(Kobayashi et al.、2013;Kobayashi、2019)。
鉄欠乏条件下でWTではbHLH105、bHLH115、BTSの発現がシュートよりも根で高く、FEP1の発現は地上部よりも根で低かった。
Li らによって提唱された FEP/IMA ワーキングモデルによると、FEP1、IVc bHLHs、および BTS の相対量が鉄欠乏応答性遺伝子の制御を決定している。
FEP1、IVc bHLHs、およびBTSは翻訳後に修飾されるため、それらのコード遺伝子の転写レベルはそれらのタンパク質レベルを反映しない。にもかかわらず、我々は根と地上部の間でそれらの転写レベルに有意差があることを観察した。
この結果は、FEP1、IVc bHLHs、および BTS の平衡状態が根と地上部で異なり、鉄または FEP1 の蓄積量の変化が根と地上部の鉄欠乏反応に異なる影響を与える可能性を示唆する。
地上部と根の反応の違いを理解するためには、これらの要因の関係をさらに詳細に分析する必要がある。
この研究で最も興味深いのは、fep1-1の皮層に鉄が強く沈着していることである。鉄は、シンプラスト経路を通じて取り込まれる。
シンプラストに取り込まれた鉄は、プラスモデスマータを通じて内皮に自由に移動すると推測されている。
fep1-1 の根のフェリックキレート還元酵素活性は WT 根と同程度であったことから、 fep1-1 の皮質での鉄沈着は導管への鉄負荷が変化した結果である可能性が考えられた。
実際、導管液への Fe 転移は、Fe 欠損 WT 植物よりも Fe 欠損 fep1-1 植物で有意に少なかった。
fep1-1 の皮層で観察された高い鉄沈着量は、fep1-1 opt3-2 二重変異体では抑制されなかった。このことは、皮層への鉄蓄積は fep1-1 シュートの表現型による二次的効果であるとは考えにくいことを示唆している。
したがって、FEP1が皮層または内皮における1つ以上の鉄輸送体の機能に必要であると考えられるが、fep1-1根の皮質におけるより高い鉄蓄積の理由は現在のところ不明である。
最近の研究では、irt1-1変異体は根から芽への鉄の移動が損なわれ、皮層への鉄の沈着がWTよりも高いことが示され、これはfep1-1の表現型を思わせる。
興味深いことに、IRT1のいくつかの点変異を用いて、IRT1がFe取り込み機能以外に根からシュートへのFe分配にも関与していることを示し、全身のFe調節に未知の調節系が存在することを示唆した。
fep1-1バックグラウンドのFEP1pro:FEP1-GFPトランスジェニック植物の根部におけるGFP免疫染色により、FEP1-GFPが、前回の研究でGUSシグナルを検出できなかった内皮に局在することが明らかになった(図6)。
これらのことから、FEP1はシロイヌナズナのSHORT-ROOTタンパク質が内鞘から皮層へ移動するように、師管付近の細胞から内皮へ移動する可能性がある。
fep1-1根のトランスクリプトームデータから、内皮での鉄輸送に関与する候補遺伝子を同定することができる。
fep1-1 の根で制御されている遺伝子のリストを探索したところ、FRD3 が鉄欠乏条件下で有意にダウンレギュレートされ、鉄欠乏条件下でアップレギュレートされていることがわかった。
しかし、FRD3 の機能喪失は中心柱への鉄蓄積を引き起こし、この遺伝子が候補となる可能性は低いことが示唆された。
YSL2も有力な候補である。このトランスポーターは根でFeをトランスロケーションすることが報告されているが、YSL2の発現はfep1-1またはER-FEP1で有意な影響を受けなかった。
また、根から分泌される化学物質の一種であるクマリンは、鉄の取り込みを促進するために皮層に蓄積し、導管液を介して植物体全体に輸送される。
シロイヌナズナのクマリン生合成に関わる2つのFIT依存性遺伝子、CYTOCHROME P450 82C4 (CYP82C4) とSCOPOLETIN 8-HYDROXYLASE (S8H) の発現 、Fe不足条件下のfep1-1根ではWTと比較して低く、FEP1誘導時に根で活性化した。
一貫して、最近の研究では、FEP2/IMA3およびFEP3/IMA1の異所性発現が、Fe不足の条件下でCYP82C4およびS8Hを活性化することを示した。
これらの遺伝子の発現の低下または増加は、それぞれ fep1-1 の根皮層における鉄蓄積または FEP1 誘導根の導管における鉄蓄積に寄与する可能性があるが、その寄与を特定するためにはさらなる研究が必要である。
fep1-1バックグラウンドのFEP1pro:FEP1-GFPトランスジェニック植物の根部におけるGFP免疫染色により、FEP1-GFPが、我々の以前の研究においてFEP1pro:GUSトランスジェニックラインでGUSシグナルを検出できなかった内皮に局在することが明らかになった(図6)。
これらのことから、FEP1は、シロイヌナズナのタンパク質SHORT-ROOTが茎から皮質へ移動するように、葉身付近の細胞から内皮へ移動する可能性がある。
fep1-1根のトランスクリプトームデータから、内皮での鉄輸送に関与する候補遺伝子を同定することができる。
fep1-1 の根で制御されている遺伝子のリストを探索したところ、FRD3 が鉄欠乏条件下で有意にダウンレギュレートされ、鉄欠乏条件下でアップレギュレートされていることがわかった。
しかし、FRD3 の機能喪失は中心柱への鉄蓄積を引き起こし、この遺伝子が候補となる可能性は低いことが示唆された。
YSL2も有力な候補である。このトランスポーターは根でFeをトランスロケーションすることが報告されているが、YSL2の発現はfep1-1またはER-FEP1で有意な影響を受けなかった。
また、根から分泌される化学物質の一種であるクマリンは、鉄の取り込みを促進するために皮質に蓄積し、木部樹液を介して植物体全体に輸送される。
シロイヌナズナのクマリン生合成に関わる2つのFIT依存性遺伝子、CYTOCHROME P450 82C4 (CYP82C4) とSCOPOLETIN 8-HYDROXYLASE (S8H) の発現 、Fe不足条件下のfep1-1根ではWTと比較して低く、FEP1誘導時に根で活性化した。
一貫して、最近の研究では、FEP2/IMA3およびFEP3/IMA1の異所性発現が、Fe不足の条件下でCYP82C4およびS8Hを活性化することを示した。
これらの遺伝子の発現低下または増加は、それぞれ fep1-1 の根皮層における鉄蓄積または FEP1 誘導根の木 部での鉄蓄積に寄与すると考えられるが、その寄与を特定するためにはさらなる研究が必要であ る。
結論として、我々のトランスクリプトーム、生理学、遺伝学的研究は、FEP1 が維管束組織の鉄欠乏 応答に関与し、シロイヌナズナの鉄のホメオスタシスに必要であることを証明するものであった。
さらに、FEP1 が関与する制御システムは、根と地上部で異なる可能性が示唆された。
最近の FEP/IMA ペプチドの分子生物学的研究と合わせて考えると、FEP1 は維管束組織の鉄欠乏応答性 遺伝子を制御し、組織間の鉄の移動に極めて重要な役割を果たしていることが示された。
また、FEP1 が細胞間を移動して、鉄の移動を制御している可能性も示唆された。
今後、FEP1 や他の FEP/IMA ペプチドの研究が進めば、植物における鉄のホメオスタシスの分子メカニズ ムをさらに解明することができるであろう。
(以下図表が多岐にわたるので、図6のみ翻訳した)
図6 FE-UPTAKE-INDUCING-PEPTIDE1 緑色蛍光タンパク質 (FEP1-GFP)をFEP1プロモーターで駆動させたfep1-1pro:FEP1-GFPトランスジェニック系統におけるGFPの免疫染色。
(a)葉の切片。
(b)aの輪郭領域の拡大画像
(c)シュート断面。
(d) cの領域の拡大画像
(e) 根の断面。
2週齢の苗を鉄欠乏培地で7日間栽培した。
組織の断面を、抗GFP抗体とAlexa-Flowを用いた免疫染色に供した。抗GFP抗体とAlexa-Fluor 555-コンジュゲート二次抗体を用いて組織の断面を免疫染色した。
Alexa-Fluor 555 の蛍光は、レーザー走査型共焦点顕微鏡で可視化した。
青色は405 nmのレーザー励起による細胞壁の自家蛍光を示す。スケールバー。100 μm。
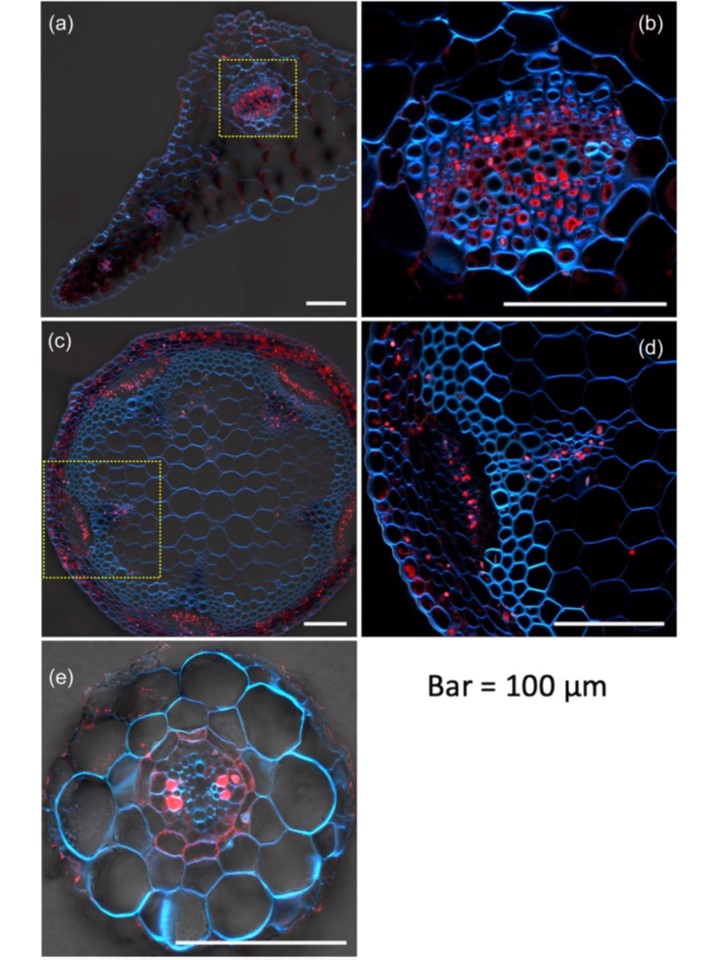
図6