植物による会合性(associative)窒素素固定の工学的制御
以下の論文はイギリスの研究グループによる力作である。本来窒素固定能を持たないイネ科の主要作物である大麦の根に会合性窒素固定菌を濃縮して菌体が窒素固定して合成したアンモニアを大麦に供給するシステムの構築にわずかながら成功している。なかなか独創的な端緒を切り開く研究である。小生にとって窒素固定は異分野なので翻訳に時間がかかった。本論文は窒素固定研究者には必読文献となると思われる。
以下に要旨とまえがきと論議と図4と図4Bno拡大図を紹介する。
Engineered plant control of associative nitrogen fixation
植物による会合性(associative)窒素素固定の工学的制御
Timothy L. Hasketta, , Ponraj Paramasivanb , Marta D. Mendesa , Patrick Greena , Barney A. Geddesa,c , Hayley E. Knightsa , Beatriz Jorrina , Min-Hyung Ryud , Paul Brette , Christopher A. Voigtd , Giles E. D. Oldroydb , and Philip S. Poolea
Author affiliations: a Department of Plant Sciences, University of Oxford, Oxford OX1 3RB, United Kingdom; b Sainsbury Laboratory, University of Cambridge, Cambridge CB2 1LR, United Kingdom; c Department of Microbiological Sciences, North Dakota State University, Fargo, ND 58105; d Synthetic Biology Center, Department of Biological Engineering, Massachusetts Institute of Technology, Cambridge, MA 02139; and e Biochemistry and Metabolism, The John Innes Centre, Norwich NR4 7UH, United Kingdom
PNAS 2022 Vol. 119 No. 16 e2117465119 https://doi.org/10.1073/pnas.2117465119 1 of 9
(要旨)
穀類と従属栄養細菌との間の窒素固定共生を工学的に研究することは、農業において生物学的に固定された窒素(N)を持続的に供給するための有望な戦略である。
私たちは以前、植物とバクテリアの間の新しいトランスキングダム(界横断)シグナルを開発した。
植物がバクテリアのシグナルであるリゾピンを生産することで、バクテリアの遺伝子発現を制御できることを発見した。
本研究では、モデル細菌である Azorhizobium caulinodans ORS571 (Ac)のリゾピン認識感度を 103 倍に向上させたホモ接合型リゾピン生産大麦系統とハイブリッド型リゾピン取り込みシステムを開発した。
この改良された遺伝子回路を用いて、我々はニトロゲナーゼマスターレギュレーターnifAと窒素代謝σ因子rpoNのリゾピン依存的な転写制御を確立し、RhiP(リゾピン生産)オオムギ根に定着した細菌がin vitroおよびin situでニトロゲナーゼを発現・活性化させることを明らかにした。
in situ での ニトロゲナーゼ活性は、野生型株と比較して最適でないものの、活性化はRhiP大麦に特異的であり、野生型株の根では観察されなかった。
本成果は、宿主植物との接触時にのみ細菌がN2を固定し、非標的植物種との相互作用が防止された合成植物制御型共生の開発に向けた重要なマイルストーンとなる。
(まえがき)
共生・会合性バクテリアによるN2固定(N2→NH3)を利用することは、現代農業の窒素(N)需要の高まりに対応するための重要な戦略である(1)。そのためには、主要な穀物作物(小麦、トウモロコシ、大麦、小麦粉など)の生産性を維持することが最も重要である。
しかし、豆類とは対照的に、穀類は窒素との密接な関連性を確立するのに必要な遺伝的要素を備えていない。マメ科植物とは対照的に、穀類は根粒菌と密接な関係を築くのに必要な遺伝的要素を持たないが、その根には自然に表在性細菌と内在性細菌が定着している。
根粒菌は、地球上の農業システムで最大 5 Tg N ha1 yr1 を固定すると推定されている。
いくつかの例では、穀類に付着性ジアゾ栄養細菌を接種することで、収量に好影響を与えている。しかし、その反応は一般的に一貫しておらず、その主な理由は、植菌が根系に競合的に定着せず、定足数密度に達しないためである。
さらに、N2固定に必要なエネルギーコストが高いことから N2固定を抑制し、植物への放出よりもNH3同化を優先するバクテリアの多層的な遺伝的メカニズムの進化を促した。
N2固定触媒であるニトロゲナーゼや根粒共生能力を直接穀類に組み込むことで、生物学的に固定されたNの供給を改善することができる。
あるいは、既存のN2固定バクテリアの相互作用を遺伝子工学的に操作することで、その機能を向上させることも可能である。
N2固定の負のフィードバック制御を克服し、過剰なNH3の生産と植物への放出を可能にすることは、後者の戦略の焦点となる。
しかし、この細菌が根に定着するための厳しい宿主特異性がないため、標的植物と非標的植物の生長促進を可能にする人工細菌形質の宿主-植物制御を確立することで、このような相互作用に特異性を持たせることができる。
植物-微生物シグナル伝達回路はすでにタバコ植物に工学的に組み込まれ、植物にバクテリアの酸を合成する能力を与えている。この能力は、細菌のアシルホモセリンラクトン(AHL)を合成する能力をもたらし、細菌のAHLバイオセンサーの遺伝子発現を活性化する。
また、AHL合成酵素を欠損したPseudomonas aureofaciensとErwinia carotovoraの変異体は、それぞれ生物防除活性と病原性を回復させた。
同様に、アグロバクテリウムを用いた形質転換により作出されたオピン産生シロイヌナズナは、根圏にオピン異化細菌を選択的に濃縮し、その比率や集団密度はオピン投入量と正相関することが示された。
しかし、AHLはシグナル特異性に乏しく、一方、オピンは病原性アグロバクテリアを誘導し、植物にクラウンゴールを形成させる。
したがって、これらのシグナル伝達回路は、農業におけるN2固定やその他の植物-微生物相互作用の制御には最適ではないかもしれない。
より実用的な植物-微生物シグナル伝達回路を開発するために、我々は大麦とクローバーに人工的生合成経路を導入し、より実用的な植物シグナル伝達回路を開発した。シグナル分子であるscyllo-inosamine (SI)を生産する人工的生合成経路である。
これが根から滲み出て、根の表面にリゾピン受容体プラスミドを持つバクテリアによって感知される。
この経路は ミオイノシトールを基質として、イノシトールデヒドロゲナーゼ(IolG/IdhA)によりscyllo-inososeに変換され、さらにアミノ基転移酵素(MosB)によってSIに変換されるが、これらはいずれも植物に構成的に発現している。
自然界では、SIと3-O-methyl scyllo-inosamine (3-O-MSI)を含むリゾピンが根粒菌によってマスターレギュレーターであるNifAの制御下で合成される。
これらは根粒から排泄されて、分解型moc遺伝子を持つ子孫株の根粒競争力を高めるが、根圏を占めるこれらの細菌の個体数を増加させることはない。
SIはシグナル分子として高い特異性を示し、根粒菌の数種類にしか存在しない。SIを栄養源として異化するRhizobiumとSinorhizobiumの数種のみが同定されている。また、SIは、オピンのように常在菌の病原性を刺激することはない。
我々は、リゾピン(rhizopine)のシグナル伝達回路を構築することでモデル穀類エンドファイトAzorhizobium caulinodans ORS571(以後Acと略す)によるN2固定を宿主植物が制御することを明らかにした。
これは、窒素固定を司る本来のnifAを、化学的に誘導可能なnifAまたはnifA-rpoNコントローラープラスミドに置き換えることで、窒素固定酵素の組み立てと機能に必要な一連のnif およびfix遺伝子の発現を促進することである。
Nの利用度に応答してニトロゲナーゼ活性を直接阻害する DraT-DraG システムのような機構は Ac には存在しないためNifAL94Q/D95Q の発現を制御することで、生成物であるNH3によるフィードバック阻害に対して部分的に抵抗性のあるN2固定を制御することができる。
本研究では(RhiP)オオムギ系統と細菌性SIレシーバープラスミドを開発し、Acのリゾピン感受性を顕著に向上させた。
この感受性の向上により、我々は nifA と NifAL94Q/D95Q をコードする変異型遺伝子のリゾピン依存的な厳密な転写制御を確立し、N代謝 σ-因子と共発現させると、in vitro で NH3 に対する部分耐性、リゾピン誘導性ニトロゲナーゼ活性を駆動した。
また、RhiPオオムギの根にコロニー形成した細菌ではニトロゲナーゼ活性が特異的にin situで活性化されるが、野生型の根にコロニー形成した細菌では活性化されないことを明らかにした。
この活性は野生型システムに比べて劣るが、本研究は植物-微生物相互作用の独占的結合の概念実証を圃場において行うものである。
(論議)
本研究では、大麦にホモ接合型リゾピン生合成経路を安定的に導入し、同時にAcのリゾピンシグナル伝達回路を改良し、ニトロゲナーゼの発現と活性を駆動するnifA-rpoNカセットの植物体依存的な制御を確立した。
リゾピンに対する感度が103倍に向上したにもかかわらず、共焦点顕微鏡およびフローサイトメトリー実験では、RhiP大麦の根に存在するAcCherry(pSIR02)集団のうち、ごく一部のみが、PmocB::GFPを発現し、RhiP大麦の根でリゾピンシグナルに応答していることがわかった。(図2)。
同様に、RhiPオオムギに結実したAcΔnifA(pSIN02)によるin situニトロゲナーゼ活性は、野生型またはRhiPオオムギに結実した野生型Acと比較して最適とは言えなかった。
RhiPオオムギから回収したAcCherry(pSIR02)コロニーはすべて、pSIR02によって伝達されるカナマイシン耐性について陽性となったことから、プラスミド損失がこれらの結果の原因とは考えにくいと思われる。
T2 RhiPオオムギの根から回収したコロニーの58〜72%が寒天培地上でPmocB::GFPをSI誘導する能力を保持していたが、サイレンシングによりin situでのリゾピン情報伝達とニトロゲナーゼ活性が阻害された可能性がある。
最後に、AcΔnifA(pSIN02)は大麦の根にコロニー形成する能力が軽度であり、野生型システムと比較して植物あたりのニトロゲナーゼ活性が低下している可能性があることが分かった。
その結果、RhiP植物によるリゾピン生産の増加は、個体および集団レベルでのSI知覚の強化につながり、細菌によるニトロゲナーゼの発現および活性がより効果的になることが示唆された。
このように、より実用に適した合成相互作用を生み出すためには、リゾピンセンサーのさらなる最適化とリゾピン生合成遺伝子の発現のチューニングが必要であると考えられる。
SI生合成遺伝子を過剰に発現させると、バイオマス蓄積に影響を与えるような植物代謝の欠陥が生じる可能性が高く、トランスジェニックオピン生産植物で以前に報告されたように、フィールドにおいて炭素または窒素源としてシグナルを異化できる特殊な細菌が濃縮する可能性が高まることに注意することが重要である。
したがって、SI生合成を機能的なバクテリア反応に必要な最小限のレベルに維持することが、この回路を最適化するために重要であると考えられる。
今回示したリゾピンによるN2固定制御を基盤として、今後は、細菌が固定したNを宿主植物に放出するよう促す、より完全な「合成共生」を工学的に実現することが目標である。
このためには、窒素代謝の再構築が必要である。Acは天然には大量の固定窒素を培地に放出しないが、PII遺伝子glnBとglnKの欠失によって放出するように設計することができるし、他の戦略によっても可能性がある。
さらに、根粒菌シグナルは、植物への応答シグナルを開始するために細菌によって展開され、根系における細菌の生物学的封じ込めを確立し、遺伝的に不適合な細菌が間接的に根粒菌に応答できるようなリレーシグナル回路を開発できる可能性がある。
最終的には、リゾピンのシグナル伝達回路を利用して、より細かいシグナルと栄養交換が存在すると推定される人工大麦根粒または「疑似根粒」内の細菌形質を制御する予定である。
本研究で得られたバイオテクノロジーの成果は、穀類とバクテリアの効率的なパートナー特異的合成共生の開発に向けた重要な画期的な標石となるものである。
以下図4の説明とず4Bの拡大写真を示す。
図4. 植物に依存したN2固定化機構のinsitu制御
(A) オオムギの根における根粒菌依存的なPnifHの発現をモニターするための実験デザインの概略図。
AcCherry細胞は、構成的に発現するmCherry遺伝子でマークされ、追跡が可能である。
この株はさらにプラスミドpSIN03を導入している。
(B) 野生型および T2 RhiP オオムギの根粒に定着した AcCherryΔnifA (pSIN03) 細胞による mCherry および GFP 蛍光を示す最大強度の投影。
RhiPオオムギをヘッドスペースで1% O2に24時間暴露した後、9dpiの時点。プロジェクションは、各処理ごとに5つの植物から切り出した3つの側根全体から取得した15枚の画像の代表的なものである。
(C) 野生型(青)、T1 RhiP(緑)、T2 RhiP(茶)の大麦の根粒・エンドスフィア(RA)または根圏(RS)から回収した細胞を、ヘッドスペース中の1% O2に24時間暴露後9dpiで分析(n = 5)した。
1,500a.u.以上のmCherry蛍光を示す細胞を解析した。
GFP+細胞は、野生型大麦にコロニー形成している集団の平均99パーセンタイル以上のGFP蛍光を示すものと定義される。
(D) CのR2 GFP+菌について、in situ PnifHプロモーター活性(GFP蛍光強度の中央値)を測定した。
(E) ヘッドスペース内を1%O2に48時間曝露した後、9dpiで行ったin situ ARAs。
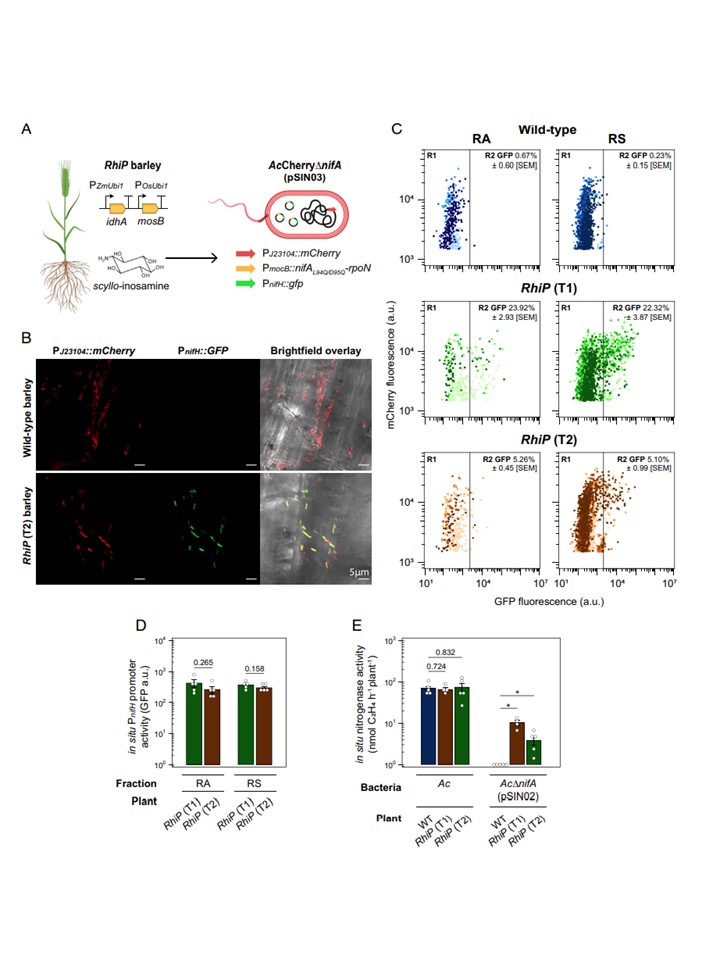
図4
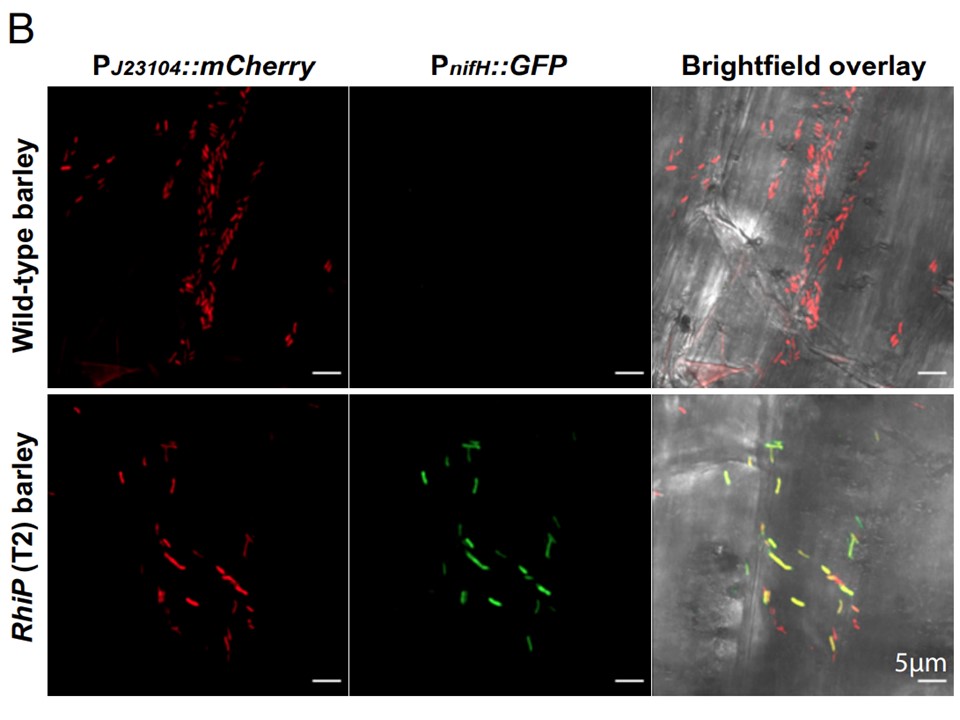
図4Bの拡大図