ミニレビュー :クロマチンによる植物の鉄ホメオスタシスの制御
ミニレビュー :クロマチンによる植物の鉄ホメオスタシスの制御
Minireview: Chromatin-based regulation of iron homeostasis in plants
Justin Su1 Zhujun Yao2 Yixuan Wu2 Joohyun Lee2 and
Jeeyon Jeong1
1Department of Biology, Amherst College, Amherst, MA, United States, 2Division of Natural and Applied Sciences, Duke Kunshu, USA
Division of Natural and Applied Sciences, Duke Kunshan University, Kunshan, China
(概要)
植物は、鉄などの栄養素の利用可能性の変化に効果的に対応するための繊細なメカニズムを利用している。
鉄の状態に対する応答は、複数のレベルでの遺伝子発現の制御を含んでいる。転写調節因子のネットワークによる鉄欠乏反応の制御は広く研究されており、最近の研究では、鉄のホメオスタシスの翻訳後制御が明らかにされている。
また、鉄欠乏時にヒストン修飾やDNAメチル化が重要な役割を果たし、植物の鉄ホメオスタシスの微調整に寄与していることを示唆する研究も増えてきている。
本総説では、シロイヌナズナとイネにおける最近の研究を中心に、クロマチンを基盤とした植物の鉄ホメオスタシス制御に関する現在の理解について述べる。
(結論と展望)
鉄ホメオスタシス遺伝子の発現は、ヒストン修飾(図1)やDNAメチル化(図2)によって影響を受けることが、次第に明らかになってきている。
このようなクロマチンベースの制御は鉄欠乏時に重要であり、植物における鉄のホメオスタシスを微調整することを可能にする。
クロマチン制御はダイナミックなプロセスであるため、鉄の状態の変化に伴うヒストン修飾やDNAメチル化の変化のメカニズムを詳細に理解することは重要である。
これまでの研究では、主に鉄欠乏に焦点が当てられており、鉄過剰がヒストン修飾やDNAメチル化を介してクロマチンリモデリングに及ぼす影響についてはほとんど分かっていない。
高鉄ストレス条件下におけるH3K9me2およびH3K4me3レベルのグローバルな変化がイネの根の中心部分裂組織で検出されたが(Polosoro et al.、2019)、その基礎的メカニズムおよび生物学的意味を理解するためにはさらなる研究が必要である。
さらに、様々なヒストン修飾、DNAメチル化、異なる修飾の組み合わせ効果に関する大規模なデータセットを統合し、特定の細胞型または単一細胞レベルでのトランスクリプトミクスとエピジェネティクスの比較解析も必要であろう。
クロマチンベースの制御はエピジェネティクスの不可欠な部分ですが、クロマチン修飾の中には遺伝しないものやエピジェネティックとみなされないものもある(Eichten et al.、2014)。
したがって、鉄に応答するクロマチン修飾の遺伝性を明らかにするための世代を超えた研究で洞察に満ちた情報を得ることができであろう。
栄養状態に応じたクロマチン構造の動的な調整とそれに続く転写変化の重要性を明らかにする証拠が増えていることを考慮すると、鉄のホメオスタシスを包括的に理解するためには、クロマチンに基づく鉄のホメオスタシスを明確に理解する必要がある。
このような努力は、長期的には、栄養プロファイルが改善され、望ましくない条件に対する耐性が強化された作物の開発に向けた洞察に貢献すると思われる。
(図1の説明)
シロイヌナズナの鉄のホメオスタシスに関与するヒストン修飾の概略。
鉄が十分な場合、PRC2を介したH3K27me3がクロマチン凝縮を誘導し、AtFIT、AtIMA1、AtYSL1などの標的遺伝子の遺伝子サイレンシングを引き起こす。
AtSKB1が誘導するH4R3sme2は、鉄が十分にある場合にもAtbHLH1bの転写を抑制する。
鉄欠乏下では、AtNRF2/ELF8はH3K4のトリメチル化を触媒してH3K4me3を生成し、AtGCN5はH3K9をアセチル化してH3K9acを生成し、H3K14acとH3K27acを容易に生成して対応する標的遺伝子を活性化させる。
配色は、メチル化(赤)、アセチル化(薄緑)、ヒストン(水色)を表す。
(図2の説明)
イネのDNAハイパーメチル化と鉄欠乏応答の模式図。
鉄が十分な条件下では、OsIRO2およびOsbHLH159プロモーターのCHH配列はメチル化されておらず、OsIRO2およびOsbHLH159は基底レベルで発現している。
鉄欠乏時には、DRM2によってOsIRO2およびOsbHLH159のプロモーター上のCHHヌクレオチドがハイパーメチル化され、対応する下流遺伝子の発現が鉄欠乏に応答して活性化される。
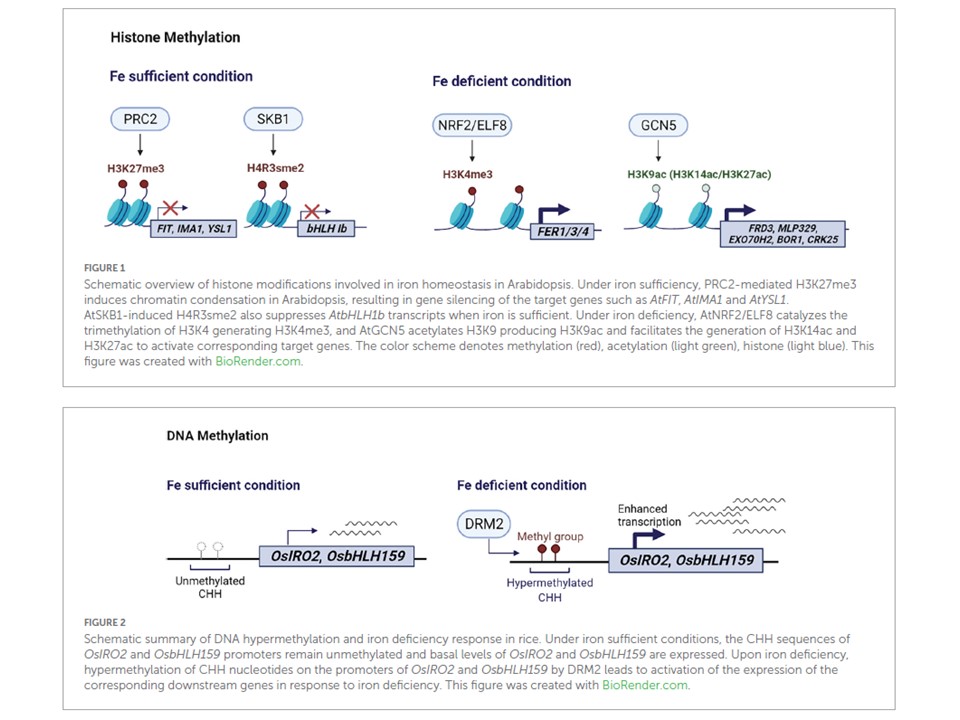
図1 と 図2