OsZIP11 はイネの鉄蓄積と発育に必要なトランスゴルジ常駐型トランスポーターである
以下の研究は機能不明の遺伝子OsZIP11の機能を解明した論文である。ある遺伝子をクローニングするとそのホモログが取れてくるので、その機能を明確にするための研究が行われることになる。ここではプライオリテイー争いが行われる。
遺伝子過剰発現や遺伝子破壊によって細胞レベルから個体レベルまでの一連の研究が要求される。これは生育期間が短いアラビドプシスレベルなら勝負が早いが、生育期間が長いイネレベルになると、結果が出るまでなかなか大変である。
人員が多い試験場レベルならまだしも、大学レベルだと、なかなか修士や博士やポスドクまで総動員しても結果が出るまでに相当時間がかかる。その上、成果が明快でないと、論文になりにくいので上司が苦労することになる。
それでも本論文に見られるように、近年ではCRISPR-Cas9の手法で遺伝子改変が容易になったので、20年前と比較すると植物での研究が急速に加速することになったようである。
中国の研究機関では学生の数が日本の10倍ぐらいいるので、こういう人海戦術を必要とする枚挙学的な課題解決型の研究課題を追っていると、日本ばかりでなく世界は負けるだろう。
OsZIP11 はイネの鉄蓄積と発育に必要なトランスゴルジ常駐型トランスポーターである
OsZIP11 is a trans-Golgi-residing transporter required for rice iron accumulation and development
Ya Ning Zhao, Chao Li, He Li, Xue Song Liu, Zhi Min Yang
Gene 836 (2022) 146678
(要約)
鉄(Fe)は植物の成長・発育に必要なミネラル栄養素である。
イネ ZRT/IRT-like protein family 金属トランスポーター OsZIP11 が鉄の輸送に関与しているかどうかは、機能的に定義されていない。
本研究の目的は、イネの成長、発達、鉄の蓄積、特に種子において、未同定のOsZIP11が果たす本質的な役割を解明することである。
一過性のサブセルラーロケーションアッセイにより、OsZIP11がトランスゴルジネットワークに標的化されていることが示された。
また、OsZIP11はイネの開花後期および種子形成期の組織(または器官)で優先的に発現していた。
OsZIP11 の転写産物は、鉄欠乏下で有意に誘導されたが、亜鉛、銅、マンガン欠乏下では誘導されなかった。
OsZIP11 配列で形質転換した酵母は、活発な鉄インプットを示し、細胞内に過剰な鉄が蓄積されることがわかった。
CRISPR-Cas9を用いてOsZIP11をノックアウトすると、イネの成長および生理的表現型が低下し、草丈の低下、バイオマスの減少、クロロシス(クロロフィル濃度の低下)、イネの幼植物におけるマロンジアルデヒド(膜脂質の過酸化物)の過剰蓄積を示すようになることがわかった。
圃場試験では、OsZIP11変異により、種子形成能力が損なわれ、円錐花序および種子の長さが短くなり、小穂の稔性が低下し、一株あたりの穀物または1000粒重が減少することが実証された。また、OsZIP11をノックアウトすると、玄米中の鉄の蓄積量が野生型に比べて48-51%低下した。
このことから、OsZIP11がイネの成長・発達に必要な鉄の獲得に必要であることがわかった。
(はじめに)
鉄(Fe)は、金属含有酵素の活性化、クロロフィルの生合成、光合成および呼吸鎖と結合した電子伝達などの多数の生物学的プロセスに強固に関与するため、植物の成長および発達に必要である(Kobayashi and Nishizawa, 2012; Andresen et al,2018)。
ほとんどの農地土壌は鉄ミネラルに富んでいるが、植物に生物学的に利用可能なFe2+のイオン形態は限られている(Marschner, 2011)。
農作物の鉄欠乏は、農業の現実において頻繁に発生し、植物の成長と発達を弱め、葉のクロロシスを誘発し、作物の収量と品質を低下させる(Kulapornら、2017;LucenaとHernandez- Apaolaza、2017)。
人間の健康に不可欠な要素の1つとして、鉄獲得に関する調節機能と分子機構を理解することは、作物による鉄蓄積の能力を向上させるために極めて重要である。
イネ(Oryza sativa L.)は、世界人口の3分の1以上を支える最も重要な作物の1つである。
イネの多くの遺伝子型や品種は、鉄吸収に寄与する特別な形質を備えている(Kulapornら、2017)。
イネは、2つの正規の鉄吸収経路を持つイネ科植物である(Gross et al.、2003)。
最初のものは、(1)ニコチアナミン合成酵素(OsNAS)、ニコチアナミンアミノトランスフェラーゼ(OsNAAT)、デオキシムギネ酸合成酵素(OsDMAS)などによって触媒されるフィトシデロフォア(MAファミリーのメンバー)などの鉄(3)キレート剤の合成を含んでいる。鉄欠乏下で、(2)MAのトランスポーター(TOM)の助けを借りて、Fe(III)キレートを根圏に放出、(3)キャリアYELLOW STRIPE Like15 (YSL15) (Bashir et al., 2006) によってMA-Fe(III)複合体を根管細胞に取り込みます。2006; Inoue et al., 2009; Nozoye et al., 2011; Kobayashi and Nishizawa, 2012; Connorton et al., 2017; Qian et al., 2019)。
第2の経路は、典型的に湛水状況で起こる特定のトランスポーターによる根への鉄(II)の直接取り込みに関する(Ishimaru et al.、2006)。
NRAMP1 (Natural Resistance-Associated Macrophage Protein1), IRT1 (Iron-Regulated Transporter 1) およびP1B-ATPaseなどのいくつかのよく知られている金属トランスポーターが、鉄の取り込みの過程で関与する (Takahashi et al., 2012; Vatansever et al., 2017).
根の表面に吸収されたイオン性の鉄は、放射状の輸送を受け、中心柱に入り、地上部にまで到達する(Kim and Guerinot, 2007)。
特定の組織における鉄(II)の長距離移動および沈着には、OsIRT1、OsYSL2、OsYSL15またはOsYSL18などの金属トランスポーターが関与している(Aoyama et al.、2009;Lee and An、2009;Koike et al.)
植物のZRT/IRT様タンパク質ファミリー(ZIP)は、主に金属の取り込み、配分、恒常性維持を行うZn/Feトランスポーターのクラスであり、ZnとFeに限定されない(Yoneyama et al.、2015)。
イネゲノムには、OsIRT1、OsIRT2およびその他の14個のOsZIPを含む一連のZIPファミリーメンバーが存在する(Milner et al.、2013;Huang et al.、2020)。
これまでのところ、OsIRT1/OsIRT2やOsZIP1-9を含むほとんどのZIPファミリーはよく知られているが、OsZIP10-OsZIP16はその機能がまだ研究されていない。
同定されたOsZIPの多くはZnやCdを輸送するが、イネのFe輸送に関与しているものはごく僅かである。
OsIRT1 と OsIRT2 は細胞膜にcomplimenntation存在し、鉄欠乏下の根で鉄を吸収する (Bughio et al., 2002; Gross et al., 2003)。
イネでOsIRT1を過剰発現させると、植物に鉄が蓄積されやすくなる(Lee and An, 2009)。
OsZIP6は、Fe、Zn、Mn欠乏下で根と芽に転写誘導される(Kavitha et al.)
OsZIP6を発現させた卵母細胞で電圧依存性電流を評価したところ、Fe、Cd、Coに応答したことから、OsZIP6が金属輸送に関与していることが示唆された。
これら以外に、イネ ZIP ファミリーのメンバーが鉄輸送に関与していることは報告されていない。
今回、我々はイネの未知なる ZIP メンバー OsZIP11 を機能的に同定した。
OsZIP11 は、鉄欠乏下で転写が上昇し、ゴルジ装置に局在していることが確認された。
酵母の相補実験により、OsZIP11の異所性発現により、細胞内に多くの鉄が蓄積されることが示された。また、CRISPR-Cas9 プロトコルを用いて OsZIP11 をノックアウトすると、イネの成長が阻害され、鉄欠乏性クロロシスの症状が見られた。
これらの結果は、OsZIP11が鉄の蓄積に必要であることを示唆している。したがって、本研究の目的は、鉄の蓄積を媒介するOsZIP11の機能的役割を解明することである。
我々の知る限り、本研究は単子葉植物において ZIP ファミリーのトランスゴルジ局在型トランスポーターが鉄獲得に関与していることを初めて報告したものである。
(実験方法の一部)
2.6. OsZIP11ノックアウト変異体系統の作製
CRISPR/Cas9 システムを用い、先に述べた方法で OsZIP11 ノックアウト株を作製した。
遺伝子5′末端付近のPAMモチーフ上流の20塩基のsgRNA (5′-CCTTGTCCGCGATGTCTCAG-3′ ) を標的配列候補として選択した。
選択したsgRNAをそのリバースプライマーで二本鎖にアニーリングし、T4 DNAリガーゼを用いてpRGEB31ベクターに導入した。
この組換えベクターを Agrobacterium tumefaciens (EHA105) を介した形質転換によりイネカルス に導入した。
CRISPR/Cas9ノックアウトoszip11系統は、T2-世代のトランスジェニックイネの葉からゲノムDNAを抽出することによって遺伝子型的に同定された。
プライマー対を用いてPCR増幅を行った。
標的部位を含むPCR産物(400-500bp)は、遺伝子編集タイプを確認するために配列決定された。
ウェブサイトDSDecodeM(https://skl.scau.edu.cn/dsdecode/)を用いて、潜在的なオフターゲットの切断は検出されなかった。
本研究で用いた3つの選択系統は、それぞれ第1エキソンにCT、GTCT、TCTCTの塩基欠失を示す。
(実験結果の一部)
3.3. OsZIP11のトランスゴルジへの局在性
OsZIP11 のコード配列の N 末端および C 末端を GFP (Green Fluorescent Protein) に連結し、さらに PCAMBIA1305 ベクターに融合させた。
CaMV 35S をプロモーターとして、OsZIP11 と GFP を発現するリコンビナントが構築された。
35:OsZIP11-GFP 融合ベクターは、
(1) PM (細胞膜) 局在マーカー PIP2A,
(2) cis-Golgi 局在マーカー (Man1-mRFP),
(3) trans-Golgi 局在マーカー (ST-RFP) という 3 つのメーカーとともにタバコ葉表皮細胞内で一過的に共 発現させた。
その結果、GFP 信号は ST-RFP と合体してトランスゴルジに明確に検出され(図 2参照)、その点状構造はこれまでの報告と同様であり、OsZIP11 はトランスゴルジ区画に局在している可能性が高いことがわかった。
(結論)
OsZIP11 は trans-Golgi コンパートメントに局在している。OsZIP11をノックアウトすると、イネの成長と発達が阻害され、植物の根や地上部の伸長、乾燥重量、葉のクロロシス、酸化ストレスが抑制されることが明らかとなった。
OsZIP11 の機能喪失変異体では、様々な組織で鉄の蓄積が少なく、特にイネ穀粒での蓄積が少なかった。
OsZIP11 がゴルジ体に局在していることは単子葉植物で初めて報告され、イネの鉄の獲得と適切な成長・発育に OsZIP11 が必要であることが示唆された。
今後は、異なる鉄供給条件下でOsZIP11がゴルジ体でどのように働くのか、また鉄の輸送や貯蔵の過程でどのようにターンオーバーするのか、そのモデルを解明することに重点を置くことになる。
以下図の説明(図1,2,6のみ翻訳した)
図1. 通常の鉄供給および鉄欠乏条件下でのイネにおけるOsZIP11の転写発現。
(A): 通常の養液で栽培した野生型イネの成長・発育段階における各組織でのOsZIP11の相対的発現量。
(B): 金属欠乏下でのシュートと根におけるOsZIP11の発現の応答。2 週齢のイネを Fe、Zn、Cu、Mn を含む養液(コントロール)または含まない養液で 7 日間生育させた。
(C) および (D): 2 週齢のイネを、Fe を含む (対照) または含まない養液で 14 日間栽培した。シュート(C)および根(D)におけるOsZIP11の転写発現。発現量は qRT-PCR によって決定した。縦棒は 3 連の平均を表す。アスタリスクは、平均値がWT株とCas9株の間で有意に異なることを示す(Tukeyの検定によりp<0.05)。
図2. OsZIP11-GFP融合タンパク質のタバコ葉表皮細胞のゴルジ体区画における細胞内局在。(A, D, G) OsZIP11-GFP (B) trans- ゴルジ体マーカーST-RFP。(C) (A)と(B)のマージ画像。バー = 10 μm. (E)シスゴルジマーカーMan1-mRFP。(F)DとEのマージ画像。バー=10μm。(H)細胞膜マーカーPIP2A-RFP。(I) GとHのマージ画像。バー = 20 μm。
図6. OsZIP11の野生型(WT)およびCRISPR/Cas9系統(C6/10/11)の形態および茎(節間)の違い。
(A)成熟期におけるWTおよびC6/ 10/11系統の表現型。(B)WTおよびC6/10/11系統のイネ株高。
(C)WT系統とC6/10/11系統の節間断面(葉間節)。
(E)WT系統とC6/10/11系統の一株当たりの蘖数の比較。(F)WT系統とC6/10/11系統の一株当たりの有効胞子数の比較。バー=10cm。縦棒は3つの生物学的複製の平均を表す。アスタリスクは、平均値がWT株とCas9株の間で有意に異なることを示す(Tukeyの検定によりp<0.05)。
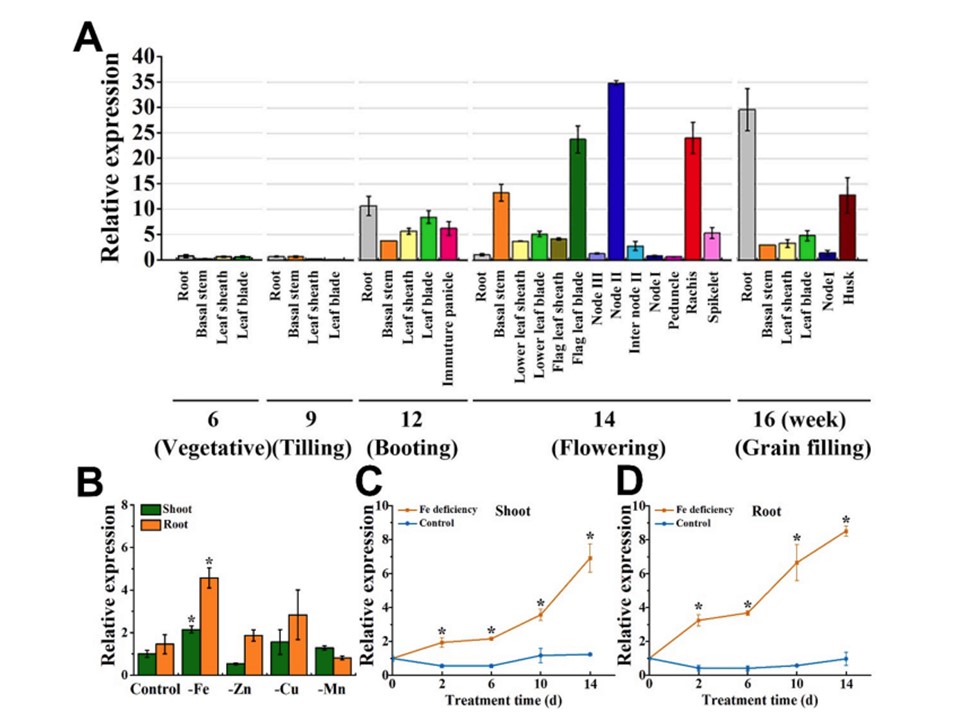
図1
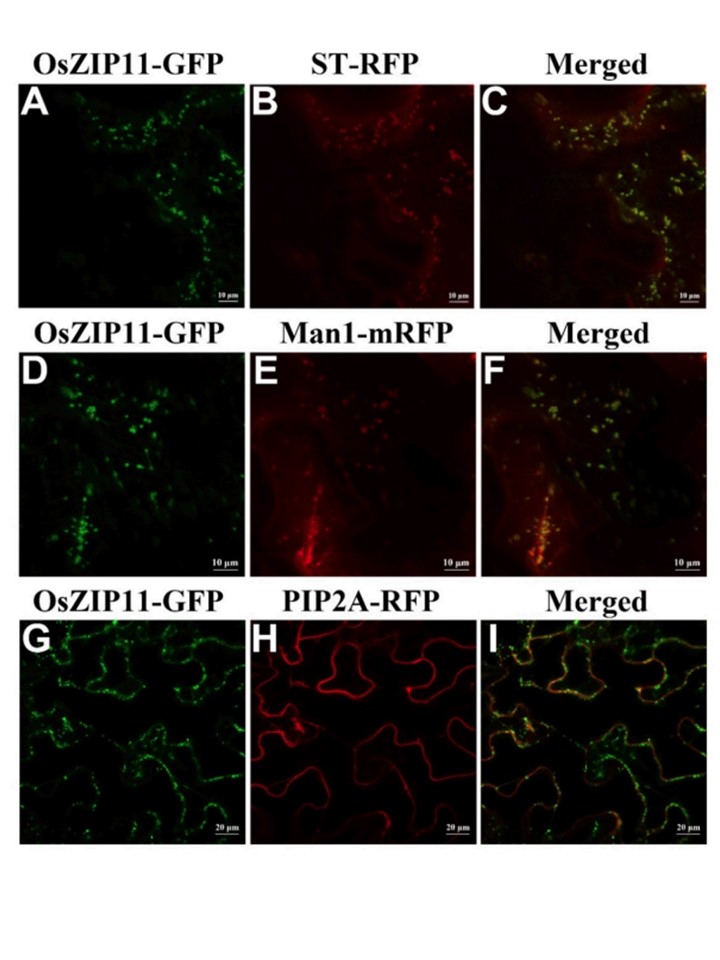
図2
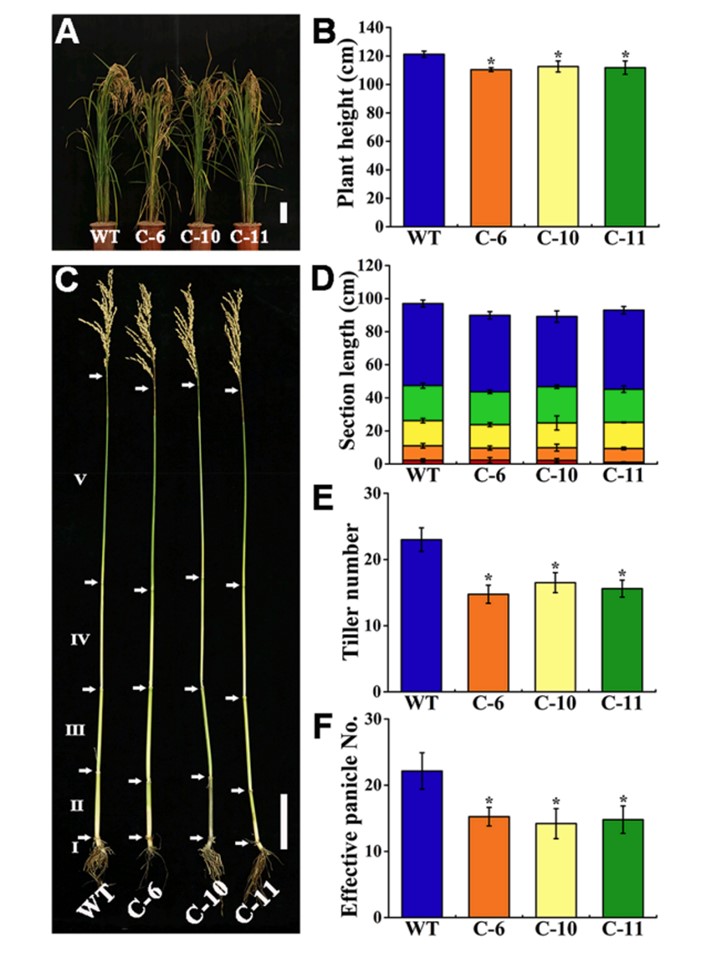
図6