植物はどのように細胞内の鉄のホメオスタシスを再調整しているのか
以下のミニレビューはなかなかよく書けているので、全文訳した。
2019−2021年間に出版された、植物の鉄栄養関係の重要論文をよく網羅して、まとめていると思う。
ミニレビュー:
植物はどのように細胞内の鉄のホメオスタシスを再調整しているのか
How Plants Recalibrate Cellular Iron Homeostasis
イザベル・クリスティーナ・ベルムデス、ウォルフガング・シュミット
Plant Cell Physiol 63(2): 154-162 (2022) https://academic.oup.com/pcp
<まえがき>
鉄の供給不足は植物に深刻な制約を与え、鉄の利用可能性が低い生息地から鉄の取り込み機構が非効率な種が排除されるので、農業生態系における収量損失を引き起こす。
また、鉄の欠乏は人間の健康にも深刻な脅威を与えている。
鉄の摂取不足による貧血は、世界の4人に1人が罹患していると言われている。
従って、植物が土壌と細胞の間の大きな勾配に逆らって鉄を獲得するメカニズムや、植物体内で鉄がどのように分布しているかを理解し、食用植物体内の鉄濃度を高める戦略を立てることが不可欠である。
植物が細胞内の鉄のホメオスタシスを調整するプロセスを研究した結果、シグナル伝達ノードと回路が驚くほど複雑なパズルのように絡み合っていることが明らかになった。この回路は、病原菌や光、栄養の有無、pHなどの風土的要因など、他の環境の手がかりを知覚し、伝達することと絡み合っているのだ。
本誌(Plant Cell Physiol)の最近のSpotlight号では、植物鉄研究の最先端をまとめた総説が掲載され、この分野で最も活発で、議論の余地がある最も重要なトピックが網羅されている。
ここでは、この総説集の出版日以降に報告された画期的な研究を取り上げ、植物の鉄栄養に関する我々の理解を変えるような、刺激的で影響力のありそうな研究に焦点を当てる。
<適材適所、適時、適量:鉄分補給の苦労話>
鉄は価数が変化しやすいため、光合成や呼吸の電子伝達系の重要な構成要素であり、生命維持のための無数のプロセスにおいて不可欠な補因子である。植物が鉄を利用できるかどうかは土壌のpHと酸素濃度に大きく依存し、ほとんどの場合、その供給量は、最適な生育のための必要量を下回っている。
自然界ではこの事が「種」の分布を制限し、多くの農業環境では作物の生育を制限している。
鉄の供給が不十分な場合、葉のクロロシス、成長の阻害、体力の低下などが起こる。
また、鉄が過剰になると、例えば湛水条件下では活性酸素の生成が増えて酸化的な障害の生成につながる。
鉄依存性タンパク質の誤作動と活性酸素の不均衡の両方を回避するために、細胞の鉄レベルを適切に調整することは、「ちょうどいい条件を」という困難なミッションである。
このため、土壌中の鉄の利用可能量が低すぎる、あるいは高すぎる場合、それを補うために、鉄の取り込みと分配を調整することを目的とした一連の反応が植物には必要となる。
鉄の取り込みは、鉄の吸収とホメオスタシスを仲介するタンパク質の量を調整するトランス作用因子、制御ペプチド、ユビキチンリガーゼなどの非常に複雑なネットワークによって制御されている。
シロイヌナズナでは、この制御ネットワークのキープレイヤーは、鉄センサーと推定されるBRUTUS(BTS)の発現を制御するclade IVc bHLHタンパク質IAA-LEUCINE RESISTANT 3(ILR3)/bHLH105 および bHLH115と、IRONMAN/PE-UPTAKE-IDUCING PEPTIDE (IMA/FEP) と呼ばれる制御ペプチドファミリー(Gao et al.2020,Grillet et al.2018,Hirayama et al.2018) である。
別のbHLHタンパク質、UPSTREAM REGULATOR
IRT1 (URI/bHLH121)は、ILR3/bHLH105、IRON DEFICIENCY TOLERANT 1 (IDT1)/bHLH34、bHLH104およびbHLH115と相互作用して、clade Ib bHLHタンパク質の転写を制御している。
別のbHLHタンパク質、UPSTREAM REGULATOR OF IRT1(URI/bHLH121)は、ILR3/bHLH105、IRON DEFICIENCY TOLERANT 1(IDT1)/bHLH34、bHLH104、bHLH115と相互作用して、clade Ib bHLHタンパク質およびの転写を制御している。直接または間接的に、マスターレギュレーターFIT/bHLH29は、クレードIbタンパク質とヘテロダイマーを形成して、根における鉄取り込み遺伝子のサブセットの転写を誘導する(Gao et al. 2020, Kim et al. 2019, Lei et al. 2020)。
最終的に、このカスケードは、オキシ水酸化物のプロトン化、キレート化、還元によって、鉄の利用率を高める一連のプロセスを引き起こす。
これが、戦略- I と呼ばれる鉄の取り込み概念である (R¨omheld and Marschner 1986)。
これに対し、イネ科植物は、還元的な鉄の取り込み、すなわち戦略- I
方式から逸脱して、鉄に高度に親和性のフィトシデロフォアに結合した第二鉄の形で取り込むシステムを採用している。これを戦略-IIと呼んでいる。
従来、この2つのシステムは互いに相容れないと考えられていた。しかし
最近、この2つの戦略の区別は弱まりつつある(下記参照)。
(しかし、イネ科植物には誘導性鉄還元酵素活性がないなどの主な違いがあり、系統的に分離した2つの異なる鉄の取り込み戦略というコンセプトは依然として有効である(Kobayashi 2019)。
これまでの本誌による包括的なレビューのフォローアップとして、我々は
これらの分野で、特集号発行後の2年間に報告された、特に重要な知見を紹介する。
この分野の文献を包括的に調査するというよりは、むしろ、鉄の獲得とホメオスタシスの概念の解釈の仕方を大きく変えることになった一連の研究に特に注目したい。
このレビューの範囲外ではあるが、ここでは詳しく説明しきれなかったが、意義の高い研究を以下にいくつか紹介したい。
鉄欠乏反応の制御におけるOsACO1のmoonlighting Function(月光浴機能?)(Senoura et al. 2020)、鉄獲得機構の細胞内ダイナミクス(Martín-Barrn, 1996)、合成フィトシデロフォアによる鉄の施肥(Suzuki et al. 2021)および種子への鉄の移行(Ch. et al. 2021)。
<OsFITとOsIMAはシロイヌナズナの機能的ホモログである>
鉄欠乏に対する典型的な反応がすべて消失したトマト変異体T3238ferの重度のクロロシス表現型は、鉄欠乏の制御の基盤となる分子機構の解明の始まりとなった。
この変異体は1970年代初頭に初めて報告され、その後、染色体6上の根に局在する因子に劣性変異があることがわかった(Brown et al. 1971, Ling et al. 1996)。
FERのクローニングにより、変異は転写因子SlbHLH85と関連付けられた(Ling et al. 2002)。シロイヌナズナのオルソログであるfer, fer-like iron deficiency-induced transcription FACTOR (FIT/bHLHLH85) のシロイヌナズナのオルソログであるFACTOR (FIT/bHLH29)が、わずか2年後に同定された(Jakoby et al. 2004, Colangelo and Guerinot 2004, Yuan et al. 2005)。それ以来、広範囲に特性評価されている(Lingam et al.2011,
Wu and Ling 2019, Gratz et al. 2019, Schwarz and Bauer 2020)。
FITは4つのクレードIb bHLHタンパク質(bHLH38、bHLH39、bHLH100、bHLH101)のうち1つとヘテロ2量体を形成し、重要な遺伝子を制御している。
その中には、戦略-Iの主要な鉄吸収プロセスを媒介する遺伝子も含まれている。たとえば、酸性化(AHA2)、キレート化 (F6′H1, S8H, CYP82C4)、還元 (FRO2)、鉄の輸送 (IRT1) などの遺伝子である。(Yuan et al.2008、Wang et al.2013)。
これまで、イネのような戦略-II型植物とトマトやシロイヌナズナのような戦略-I型植物とでは、制御カスケードが大きく異なると考えられていた。しかし
鉄のホメオスタシスの制御は、この2つのモデル植物間では、結局のところ、それほど違いはないようだ(Grillet and Schmidt 2019)。
この見解は、最近になってより多くの支持を得た。2つのグループが独立して
FITの機能的なイネホモログであるOsbHLH156を同定した(Liang et al.2020、Wang et al.2020)。
AtFITやそのトマトのホモログSlFERと同様に、OsFITはclade IIIa bHLHタンパク質であり、クレードIbタンパク質であるIRO2 (bHLH56; Ogo et al., 2006, Liang et al. 2020, Wang et al. 2020)とヘテロダイマーを形成している。
OsFITに変異があると、植物のフィトシデロフォアの合成と輸送に関わるいくつかの重要な遺伝子の発現が低下することから、OsFITが戦略-II型鉄吸収の誘導に重要であることを示している。
また、OsFITを破壊すると、イネの鉄の取り込みシステムの戦略-Iの構成要素であるOsIRT1の発現も低下した。
OsFITの発見により、被子植物の鉄のホメオスタシスを制御するネットワークが明らかになった。
また、イネとシロイヌナズナが鉄のホメオスタシスを制御する上で非常によく似ていることも明らかになった。このことは、鉄欠乏応答の制御におけるイネとシロイヌナズナの密接な類似性を強調するものである。
ペプチドファミリーIRONMAN (IMA) はシロイヌナズナで最初に同定され、
最近、イネでも同様の役割を果たすことが示された(Grillet et al.2018,
Hirayama et al. 2018, Kobayashi et al. 2021)。名前の由来は IMA/FEP遺伝子を過剰発現させた遺伝子組換え植物が鉄・マンガン蓄積表現型であることに由来する(Grillet et al.2018).
IMA/FEPペプチドは、C末端にモチーフを持ち、それは被子植物全体で高度に保存されており、FITの上流に作用することによって、戦略-I応答を誘導するのに十分である(Grillet et al, Kobayashi et al. 2021, Gautam et al. 2021)。
シロイヌナズナではIMA1/2の発現は、bHLH121とbHLH105/ILR3によって発現が正に制御されている(Kim et al.2019、Gao et al.2020)。
2つの推定イネホモログ、OsIMA1およびOsIMA2が、シロイヌナズナで異種発現させると鉄欠乏反応を誘導することが示されたが、イネでの遺伝子の機能的な特徴付けが欠けていた(Grillet et al.) がこのギャップは最近埋められた。シロイヌナズナで観察されたのと同様に、イネの両ホモログの発現は、クレードIVcタンパク質(OsbHLH058およびOsbHLH059)の制御下で発現が強く誘導された(Kobayashiら、2019)。
2つのイネIMA遺伝子のいずれかを過剰発現させたところ鉄の蓄積と、鉄取り込み遺伝子のサブセットの発現が促進された(Kobayashi et al.2021)。
シロイヌナズナとイネでは、IMAはbHLHサブグループIbタンパク質とFITをコードする遺伝子を制御しており、IMAは制御カスケードのかなり上流に位置している(Grillet et al.2018, Hirayama et al.2018, Gautam et al. 2021、Kobayashi et al. 2021)。
IMAがイネ科と非イネ科の両方で機能しているという観察から イネ科の種が分岐する前にIMAが進化してきたことが推測される。
実際、イネ科の最も古い生物種のゲノムにIMA遺伝子が存在することは、
陸上植物においてIMAが早くから出現していたことを示唆している。
しかし、イネとシロイヌナズナでIMA遺伝子の数が異なる理由は不明である。
シロイヌナズナゲノムには8つのIMA遺伝子が存在し、そのうち機能的に解明されているのは3つ(IMA1,2,3)だけである (Grillet et al. 2018, Hirayama et al. 2018,Gautam et al.2021)。
シロイヌナズナでは、IMAが鉄の取り込み以外の機能で採用されている可能性
や、特定のIMAペプチドは、鉄欠乏反応の特定の構成要素を多少異なるターゲットで微調整するために必要である可能性がある。
最も重要なことは、OsIMA1またはOsIMA2のいずれかを過剰発現させると、
種子の鉄分濃度を約3倍上昇させ、低鉄分に対する耐性を付与することができたことである。
これは、鉄欠乏性貧血に対抗するために重要な、中性またはアルカリ性土壌での生育に有利な表現型である。
陸上植物の鉄のホメオスタシスにおけるIMAペプチドの重要性は十分に確立されていると思われるが、IMAが細胞内の鉄量を調節する分子機構は、これまで明らかにされていなかった。
最近の研究により、bHLH115およびbHLH105と競合し、C末端の保存ドメインを介してBTSと結合することで、IMAがE3リガーゼBTSを隔離することを示した(Liら、2021)。
BTSによる bHLH115とbHLH105の分解の緩和は、IMAを含む鉄応答性遺伝子の発現を促進することにより、bHLH115とbHLH105とIMAペプチドの間で正のフィードバックループを形成している(図1)。
BTSによるIMAの分解によって、鉄欠乏反応の活性化と抑制のバランスが崩れ、最終的に根による鉄の吸収が減少する。
IMAペプチドのC末端と、BTSとそのイネのホモログであるHaemerythrin motif-containing Really Interesting New Gene (RING)- and Zinc-finger protein 1 (HRZ1/HRZ2; Kobayashi et al. 2013)とが類似していることから、イネや、おそらく他の 戦略-II植物も、同様のメカニズムで鉄を感知し 鉄レベルに応答するメカニズムを採用していると考えられる。
<URIが鉄のシグナル伝達パズルの重要なピースを完成させた>
AtFITとそのオルソログは、鉄の統治体制に対して転写的に応答している。
このことは、上流の転写因子が関与していることを示している。
シロイヌナズナでは、FITの発現は、4つのclade IVc bHLHタンパク質(ILR3/bHLH105, IDT1/bHLH34, bHLH104およびbHLH115)により制御されている。これらは、直接的にclade Ibの転写を制御し、間接的にFITを制御する(Gao and Dubos 2021年総説;Fig.1)。
ILR3は鉄の取り込みの活性化因子としても抑制因子としても働き、後者は抑制的な転写因子であるPOPEYEとヘテロダイマーを形成することで 鉄の取り込みを抑制する(PYE; Long et al.2010、Tissot et al.2019、Kroh and Pilon 2020)。
ILR3や他のbHLH IVcタンパク質がどのように鉄の取り込みを促進するのか
は、最近まで不明なままであった。
ルシフェラーゼ遺伝子をIRT1プロモーターで駆動することができない変異体の前方遺伝学的(forward genetic) スクリーニング(Kimら、2019)、ILR3の共免疫沈降と液体クロマトグラフィータンデム質量分析(Gaoら、
2020)、FITプロモーターを餌とする酵母ワンハイブリッドスクリーニング(Leiら、2020)の3つの異なるアプローチを採用し、パズルのミッシングピースである clade IVb bHLHタンパク質 URI を特定した。
鉄欠乏条件下でURIは、鉄欠乏条件下でリン酸化され、プロモーターとの結合を促進する修飾を受ける。
この修飾は、その標的のプロモーターへの結合を促進するものである
(Kim et al.2019)。また、URIタンパク質の細胞内局在は、細胞内シグナル伝達機構によって決定される。
URIタンパク質の細胞内局在は、植物の鉄の状態によって決定される。
鉄の量が不足すると、URIが中心柱/内皮から移動し、皮質/表皮に移動し、鉄の吸収を促進することが知られている(Gao et al.2020)。
サブグループIVc遺伝子と同様に、URIは鉄によって転写制御されておらず、鉄応答性遺伝子のカタログ化を目的としたトランスクリプトーム解析において、事前に同定され得なかった。
転写調節の代わりに、リン酸化URIのレベルは、BTSを介したプロテアソーム分解によって調節され(Kimら、2019)、この運命は、サブグループIVcタンパク質について以前に記述されているとおりである(Longら、2010、Seloteら、2015)。
BTSはURIの直接の標的であり、URIが初期の鉄感知/シグナル伝達イベントに関与していることを示している。URIはIMA1やIMA2の発現も直接的に活性化する(図1)。
<光と鉄のシグナル伝達経路のHY5における収斂>
鉄の需要は相対的な植物の成長速度に依存し、植物の成長過程で変化する(Grusak 1995, Schmidt and F¨uhner 1998)。
葉や種子などの吸収器官の鉄需要を根に伝え、土壌からの鉄の吸収を調整するためにはシグナル伝達経路が必要である。
FITをはじめとする多くの鉄取り込み遺伝子の発現は根に限られるため、長距離通信手段が必要であることが強調されてきた。
このような根から地上部へのシグナル伝達を示す初期の証拠は、鉄を構成的に欠く植物体との相互接ぎ木実験から得られた。
エンドウの鉄欠乏性構成的突然変異体brzとdglを用いた接ぎ木実験から得られたもので、葉に由来する因子が突然変異体表現型の原因であることが示唆された(Welch and LaRue 1990, Grusak and Pezeshgi 1996)。
さらに、根系の一部を鉄のない養液にさらし、残りの半分を鉄にアクセスさせる根分け実験では、根の鉄吸収を調整するために、局所的および全身的なシグナルが統合されるという概念を支持した(Schmidt and Schikora 2001, Vert et al. 2003)。
葉の鉄の状態がどのように根に伝えられるかという疑問は、長年の課題であった。
光化学系は鉄を含むタンパク質を豊富に含んでおり、植物における鉄の最も強力な吸収源(シンク)である。
鉄欠乏の感知は葉の維管束系で最も速く起こるようであり(Khan et al.2018)、シンク器官における鉄欠乏の感知と全身的なシグナル伝達が根の鉄吸収の制御における初期要因を構成することが示唆された。
したがって、以下のように考えることは妥当である。
おそらく他の細胞部分における鉄の感知に加え、葉緑体で鉄を感知していると考えられる(Bienfait et al.1987)。
このシナリオでは、根による鉄の取り込みは、葉緑体逆行性シグナルと鉄の状態の組織間伝達の両方によって支配される。
鉄と光シグナリングをリンクさせることは、鉄の需要と根の取り込みを統合するための論理的な接続であると思われ、この枠組みは、最近、トマト植物におけるELONGATED HYPOCOTYL 5(HY5)のフィトクロームB依存性蓄積と鉄シグナリングの間の予期せぬ接続を明らかにした新しい知見によってサポートされている(Guo et al.、2021年)。
HY5は葉から根へ移動することができる塩基性ロイシンジッパー(bZIP)転写因子である(Chen et al. 2016).
鉄欠乏条件下で、HY5はトマトのFITオルソログであるSlFERのプロモーターに結合し、鉄取り込み遺伝子の発現を誘導し、その結果鉄の取り込みを誘導することがわかった。
HY5は葉と根の両方に存在するが、相互接ぎ木実験により、シュート由来のHY5がFERの活性化に重要であることが示された。
このように、HY5はシンクからソースへの鉄の状態を伝える、待望のモバイルシグナルである。
しかし、HY5にどのような特異性が与えられているかはまだ不明である。
HY5は窒素、リン酸、銅の獲得に関与しており(Zhang et al. 2014, Chen et al. 2016, Sakuraba et al. 2018)、HY5が他の制御因子と協調して鉄の取り込みを支配している可能性が示唆された。
興味深いことに、HY5の過剰発現は、植物が鉄欠乏を経験している場合にのみ、鉄欠乏反応を誘導した。この観察は、これまで、FERやFITの過剰発現で観察されたことと似ている。
鉄が十分な条件下では顕著な効果を示さないことは(Brumbarova and Bauer)
(Brumbarova and Bauer 2005, Meiser et al. 2011)極めて重要なことである。
鉄応答性遺伝子の多くは、プロモーターにHY5との結合を可能にするコンセンサスモチーフを有しており、この事は、HY5が鉄のシグナル伝達においてより広い役割を担っていることを示唆している。
HY5がどのようにFERの転写活性化という図式に当てはまるのか、そしてHY5がシロイヌナズナで同様の役割を果たすのかどうかは、まだ解明されていない。
<鉄を取り込む補助的・正統的システムが鉄の輸送をオーガナイズする>
シロイヌナズナでは、高親和性トランスポーターIRT1が根細胞への鉄の唯一の侵入口を制御しているという推測は、植物の鉄研究において長年のドグマであった。
その発見以来、いくつかの研究により、土壌からの鉄の取り込みを媒介するIRT1の重要な役割が確認されている(Eide et al. 1996、Vert et al. 2002, 2003、Barberon et al. 2014、Dubeaux et al. 2018)。
異なるグループによって独立して実施された2つの研究は、最近、この仮定に異議を唱え、このような見解はもはや妥当ではない。
IRT1に依存しない補助的な鉄の取り込みシステムの可能性は、リン酸欠植物における鉄レベルの上昇とそれに伴うIRT1の発現抑制から推測され、以前から仮定されていたが、後者の条件下で鉄がどのように根に入るかは、これまで不明であった(Tsai and Schmidt 2017aに総説あり)。
リン酸欠植物に典型的な鉄の取り込みの増加は、irt1変異体でも観察され(Hoehenwarter et al.2016)、非正規のIRT非依存的な鉄の取り込みという命題を裏付けるものである。
このように、IRT1ドグマは、リン酸塩欠損のジレンマによって弱体化したのである。
しかし、代替物質に関する確固たる証拠は見つかっていなかった。
最初の研究では、フィトシデロフォアシステムに類似した方法で根から分泌されたクマリンを鉄と複合化させた後、IRT1非依存的に取り込むことを報告した。このことは、イネ科植物と非イネ科植物の鉄の取り込み戦略の主な違いに反する発見である。
従来、クマリンは鉄をキレート化および還元することで動員し、FRO2/IRT1を介した鉄の取り込みの基質となると考えられていた。このシステムは、利用可能な鉄をほとんど含まない石灰質土壌で成長する能力を付与しているが(Tsai et al.2018)、クマリンは連続的に生産され、最終的には根圏で分解される。
生態学的な観点から、より考えられるシナリオは、鉄をキレートした後に分泌された化合物を再摂取し、複合体から鉄を放出した後にクマリンを再利用し、無毒なグリコシドとして貯蔵することである。アグリコンとして再分泌される前に、無毒な配糖体として保存される。
戦略-I植物における植物由来鉄キレートの取り込みシステムは、以前から想定されていた。この仮説は、植物性シデロフォア(Phytosiderophores)の分泌物の観察に基づくものである。
イネ科植物が分泌するファイトシデロフォアは、イネ科以外の植物の鉄栄養にも貢献することができる。
この仮説は、例えば、ピーナッツとトウモロコシで観察されたように、イネ科植物が分泌するファイトシデロフォアが非イネ科植物の鉄栄養に貢献するという観察に基づいている(Xiong et al.)。
このたび、(Robe et al. 2021a)の研究により、そのようなメカニズムの分子的な証拠が示された。
f6′h1変異体は、フェルロイルCoAから6′-ヒドロキシフェルロイルCoAへの変換に欠損がある。スコポレチンおよび下流のクマリンの生合成を損なう(Schmid et al.2014)。生合成経路のこの段階が欠損している変異体は、クマリンを全く含まないため これらの化合物の取り込みの可能性を調査するための優れたツールを提供する。
特に、f6′h1変異体植物は、野生型植物と一緒に栽培すると、グリコシル化されたクマリンを含むことがわかった。このことは、活性のあるアグリコン型で分泌されたクマリンは、メリーゴーランド的なリサイクル回路で再分泌される前に、グリコシル化されて、グリコシドとして貯蔵されうることを示唆している(Robe et al.、2021b)。
同じグループによる追跡研究で、カテコールクマリンであるフラキセチンと形成されたFe3+複合体は、実際に1:3の割合でシロイヌナズナの根に取り込まれ、irt1変異体を部分的に救済できることが実証された(Robe et al. 2021a)。
このように、戦略-I植物は、弱酸性条件で最もよく働くFRO2/IRT1依存性の鉄取り込みと、クマリン生合成酵素S8Hの発現を調節することでpH上昇時に活性化するIRT1非依存のクマリン媒介性の鉄取り込みという2種類の鉄取り込み機構を用いているようである(Tsai and Schmidt 2017b;Gautamら2021年)。
しかし、鉄-クマリン複合体の取り込みを媒介するトランスポーターはまだ特定されていない。
ここで紹介する2つ目の研究では、IRT1の意外な機能を報告している(Quintana et al.2021)。irt1変異体では、鉄濃度が野生型植物と同等かそれ以上に高いにもかかわらず、この鉄を地上部に移動させることができない。
戦略-I植物における植物由来鉄キレートの取り込みシステムは、以前から想定されていた。例えばピーナッツ/トウモロコシ間作システムで観察されたように、イネ科植物が分泌するフィトシデロフォアが非イネ科植物の鉄栄養に貢献できるという観察に基づいていた(Xiong et al.2013)。
この観測は、以前 にもなされており、鉄はアポプラスト中に沈殿しており、IRT1が機能していないと容易に取り込むことができないせいであるとされてきた。
この結論から逸脱して、著者らは、少なくともこのプールのサブフラクションが根の細胞に取り込まれることを示し、IRT1非依存的な鉄の取り込みの概念を支持するものであった。しかし、irt1植物では、根の鉄プールは茎に輸送されない。
このことは、IRT1が鉄の根への取り込みに重要な役割を果たしていることに加え、根から地上部への鉄の輸送にも重要な役割を果たしていることを示唆している。 (Quintana ら、2021年)。
IRT1タンパク質の輸送に必須な残基であるSer206に変異を導入したコンストラクトでirt1変異体を補ったところ、根からシュートへの鉄の分配能力を一部回復させ、irt1変異体のクロロシス表現型を回復させた。このことから、IRT1は未知のメカニズムにより、シュートへの鉄転流を間接的に支援していると考えられる。
興味深いことに、irt1変異体のトランスクリプトーム検索から、転写調節因子MYB72とMYB10の発現が、そして推定上のMYB72の標的であるBETA GLUCOSIDASE 42 (BGLU42) の発現がIRT1の機能依存的であることが明らかになった。
MYB72とMYB10は、アルカリ性土壌での生存と鉄固定化クマリンの生産に重要であり、この観察結果は因果関係があるように思われる(Palmer et al.
2014、Zamioudis et al. 2014、Stringlis et al. 2018、Gautam et al.
2021).
BGLU42はクマリンの脱グリコシル化に重要であり、根圏への分泌に必要である。
したがって、IRT1の機能不全が、葉の深刻な鉄不足を補うために、鉄と複合したクマリンの生合成、分泌、そしておそらくは取り込みを引き起こすと推測することは魅力的である。クマリンを介した鉄の取り込みはpHが高いときのみ機能するため、酸性条件下での鉄の取り込みにIRT1が不可欠であることを説明することは重要なことである。
<微生物による鉄の取り込みを支援する鉄の獲得システムのアウトソーシング>
根の微生物群は、土壌中のミネラル栄養素の利用可能性を向上させる上で重要な役割を果たし、植物の根に由来するシグナルに応答して、間接的ではあるが、菌類病原体に対する防御を提供する(Stringlis et al.2019, 2021)。
また、根面常在菌は、植物の地上部ストレス応答を支配し、優先させることが明らかになった。微生物-根-地上部のコミュニケーション回路が植物のフィットネスに貢献していることが示唆された(Hou et al. 2021)。
根の生物相の構造と活性は、土壌因子と特に、植物の根から排出されるスコポレチン、フラキセチン、サイドレチンなどのクマリン類(Stringlis et al.2018, 2019, Voges et al. 2019、Harbort et al. 2020、Hou et al. 2021)に支配されている。
クマリン生産の障害は、特に鉄欠乏条件下で根由来微生物コミュニティーの組成のシフトを引き起こし、この事は、鉄稼働化クマリンが微生物の根の常在菌の構造と活動に影響を与えるという仮定を支持する(Voges et al.2019)。
Vogesらの研究では、さらに、カテコールクマリンがPseudomonas strain sp. Root329の増殖を抑制したが、宿主に有益なPseudomonas simiae WCS417の増殖は抑制しなかった。このことは、根のマイクロバイオームにおけるこのような変化が植物にとって有利になることを示唆している。
最近の研究では、フラキセチンは、その直接的な鉄稼働化活性に加えて、コムギの生育刺激に必要であることを示した(Harbort et al.2020)。
著者らは、スコポレチンおよびフラキセチンの分泌を欠損した変異体が、鉄制限土壌において野生型とは異なるマイクロバイオームを構築したことを報告し(Harbort et al.2020)、人工石灰化土壌(Stringlis et al.2018)および人工培地(Voges et al.2019)による実験から得られた以前の観測を確認した。
特に、共生生物が存在すると、f6′h1変異体のクロロシス表現型を救うために必要なフラキセチンの濃度が低下した。このことは、クマリンが土壌中の難分解性の鉄プールを動員する以上の機能を持っていることを示唆している(Harbort et al.2020)。
このように、植物の根とマイクロバイオームとの間の化学的コミュニケーションは、双方向的であるように思われる。しかし、植物がマイクロバイオームの構造を形成し、根の微生物群集が宿主の鉄の獲得を改善するという仮説を支持する証拠がある一方で、後者については、どのようなメカニズムが支配しているのかはまだ不明である。
善玉菌が分泌を促進するだけでなく、クマリンの取り込みも促進することで、このシステムをより効率的にしている可能性がある。
さらに また、病原菌の繁殖が抑えられると、根圏での鉄の争奪戦が減り、間接的に鉄の取り込みが向上するために植物の生育が良くなる。
さらに、バクテリアのシデロフォア(siderophore)を取り込む利点もあるとおもわれる。このシナリオは、さらなる調査が必要であるが。
いずれにせよ、鉄の吸収は、常在菌の存在下で著しく改善されるようである。
微生物コミュニティが存在すると、鉄の獲得が大幅に改善されるようだ。
このように、マイクロバイオームの構造を変えることは、アウトソーシングすることで、植物の機能的なレパートリーを増やすことになりうる。
<ニコチアナミン:バイオフォーティフィケーションにおける「二重の代理人」>
世界の人口の大部分は植物性食品に依存している。鉄分不足による鉄欠乏性貧血のリスクがある。鉄欠乏性貧血は、世界的に最も一般的な微量栄養素の欠乏症であり、世界的に最も一般的な微量栄養素の欠乏症であり、世界中で約16億人が罹患している。(de Benoist and Clugston 2002, Camaschella 2019)。
鉄の栄養失調を回避し、公衆衛生を向上させるために、過去数十年にわたり相当な努力が払われてきた。鉄の含有量が高い品種の開発は、バイオフォーテイフィケーションと呼ばれる。
この概念は、農学的手法や伝統的な育種から、さまざまな遺伝学的アプローチ
(Connorton and Balk 2019)までを意味している。
鉄のバイオアベイラビリティ、すなわち、鉄の吸収量は、小腸で吸収される鉄の量である。これはバイオフォーテイフィケーションの効率を決定する第二の主要な要因である。
体内への吸収量は食用植物に含まれる鉄の含有量に比例せず、フィチン酸塩、タンニン、ポリフェノールなど、食品に含まれるいくつかの化合物によって鉄の吸収が阻害され、効果が相殺される。
一般に、植物性食品の非ヘム鉄は、動物性食品のヘム鉄よりも吸収率が低い。
動物性食品の非ヘム鉄は、動物性食品のヘム鉄に比べ、吸収率が低い。非ヘム鉄は、そのほとんどが不溶性の第二鉄の形で存在し、十二指腸のチトクロームで還元する必要がある。
二価の金属イオン輸送体1 (Dcytb) を介して取り込まれる前に、十二指腸チトクロームb (Dcytb) による還元が必要である。
金属イオン輸送体1(DMT1)を介して取り込まれる。しかし、Dcytbノックアウトマウスは鉄に関する特定の表現型を示さなかったことから、鉄の別の侵入経路、おそらく何らかの食餌性因子によってキレートされていることが示唆された(Gunshin et al.2005)。
最近の研究では、このような鉄の代替経路の基礎となるメカニズムに光が当てられ、バイオ フォーティフィケーションにおけるニコチアナミン(NA)の特別な役割が明らかになった。
(NA)がバイオフォーティフィケーションのアプローチにおいて特に重要な役割を果たすことが明らかになった(Murata et al.2021).
NAは、NA-auxotrophのクロロネルバ変異体の構成的な鉄結合症の表現型を元に戻す「正常化因子」として最初に報告された非タンパク質性アミノ酸で、高等植物に普遍的に存在し、鉄や銅などの金属の捕捉と移動に関与する金属キレート剤である(Poch´azka and Scholz 1984)。
イネ科の植物ではムギネ酸系のフィトシデロフォア(phytosiderophore)の前駆体として機能している。
クロロネルバ変異体のクローニングにより、NA合成酵素の1塩基が変化していることが判明した。(NAS; Ling et al.1999)。
この酵素は鉄のホメオスタシスにおけるそのユニークな役割から、NAは鉄のバイオフィルトフィケーションの頻繁なターゲットであった。
NASの異所性発現は、作物の鉄含有量を増加させ(Nozoye 2018)、また、
マウス、ニワトリ、Caco-2細胞で貧血症状を回復させた(Zheng et al. 2010, Lee et al. 2012, Beasley et al. 2020)。
NAキレート鉄は生物学的利用能が高いことがわかる。
しかし、NAを過剰発現させた植物で鉄の利用率が向上した理由は、ほとんど解明されていない。
NAは、生物学的利用能の高いFe2+イオンと不溶性のFe3+イオンの両方をキレートする(von Wir´en et al. 1999)。
この特性は、生物学的強化剤としての役割を果たす上で重要な要素であると思われる。村田ら(2021)は、この特性により、鉄-NA複合体が、通常の非ヘム鉄の取り込み経路を迂回することを明らかにした。その代わり、Fe-NAは、プロトン結合型アミノ酸トランスポーターSLC36A1を介して腸内で効率的に吸収され、膜貫通型鉄輸送体フェロポルティン1を通じて腸管細胞から血液中に排出される。
腸管細胞のどこでどのようにNAからFe2+が遊離されるかは不明である。
村田らの研究により、植物体内のNAを増やすことは、鉄の含有量を増やすための効率的な戦略であるだけでなく、植物性食品における鉄の生物学的利用能をサポートするものでもあることが示唆された。
植物性食品における鉄の生物学的利用能の向上が期待される。
NAはユビキタス作物や野菜に普遍的に存在するため、特定の作物や野菜に限定されない。
また、村田らの結果は、NASの異所性発現による鉄強化植物の作製に加えて、
NA-Feサプリメントは、鉄欠乏性貧血のリスクを軽減するための代替手段となる可能性がある。
(結論)
植物がどのように環境変動する鉄の利用可能性に対処し、細胞内のレベルを一定に保つのかについて、過去2、3年の間に多くのことが明らかにされた。
特に、最近の研究で、イネとシロイヌナズナの間にさらなる類似性があることが明らかになり、2つの鉄取り込み戦略の境界が曖昧になっていることが顕著である。これらのデータを考慮すると、少なくとも概念的には、2つの鉄獲得戦略は完全には排他的ではないようである。
最近の研究から、イネやシロイヌナズナが採用している鉄の状態のモニタリングや鉄欠乏応答の上流調節機構に関する知見が得られたが、様々なシグナルが統合されて特定の応答を優先させる仕組みについては、まだ多くの知見が残されている。
例えば、クマリンの分泌を調節するために外部のpH情報を伝達する推定シグナルと、植物の異なる部位間で鉄の状態を伝達する推定システムシグナルとの相互作用は、まだほとんど分かっていない。
また、クマリンの分泌が、植物の「助けを求める」反応にどのように関与し、有益なバクテリアの動員や鉄の吸収を促進するのかも明らかにされることが待たれている。
これらの情報をもとに、土壌からの鉄の取り込み効率が向上し、食用植物体中の鉄濃度が高くなるような植物が生まれることが期待される。
The walrus and the carpenter were walking close at hand; they
wept like anything to see such quantities of sand: ‘If this were only
cleared away’, they said, ‘it would be grand!’
Lewis Carroll
(この詩の意味が小生には分からないので訳しませんでした)
(図1の説明)
URIは、鉄のシグナル伝達カスケードにおいて中心的な位置を占めている。URI/bHLH121は、ILR3や他のclade IVc bHLHタンパク質とヘテロダイマーを形成して、下流の標的を制御している。
鉄がない場合、URIはリン酸化によって活性化され(青色の泡で示す)、標的のプロモーターへの結合を促進する。
鉄が存在すると、E3ユビキチンリガーゼBTSが活性化され、転写因子複合体のプロテアソーム分解を仲介して鉄シグナルを停止させる(紫色の三角形で示す)。
鉄がない場合、IMAペプチドはBTSの結合と競合し、下流の遺伝子の転写を誘導する。
FITはURIによって間接的にclade Ib bHLHタンパク質が誘導されることで制御され、FITとヘテロダイマーを形成して酸性化(AHA2)、還元(FRO2)、鉄の取り込み(IRT1)を介して土壌からの鉄獲得を仲介する遺伝子の転写をアップレギュレートしている。また、FIT/bHLHIbは、MYB型転写因子MYB72の誘導を介してクマリンの生産・分泌を制御し、高pHでの還元、キレート、鉄の取り込みによる鉄獲得を補助している。
Fe3+-クマリン複合体は、FRO2によって還元され、放出された鉄はIRT1によって取り込まれる。
あるいは、Fe3+-クマリン錯体をそのまま取り込む可能性もある。鉄-クマリン複合体の取り込みのためのトランスポーターはまだ見つかっていない。
ここに示すモデルは、Kimら(2019)、Leiら(2020)、Gaoら(2020)、Liら(2021)の報告データに基づくものである。
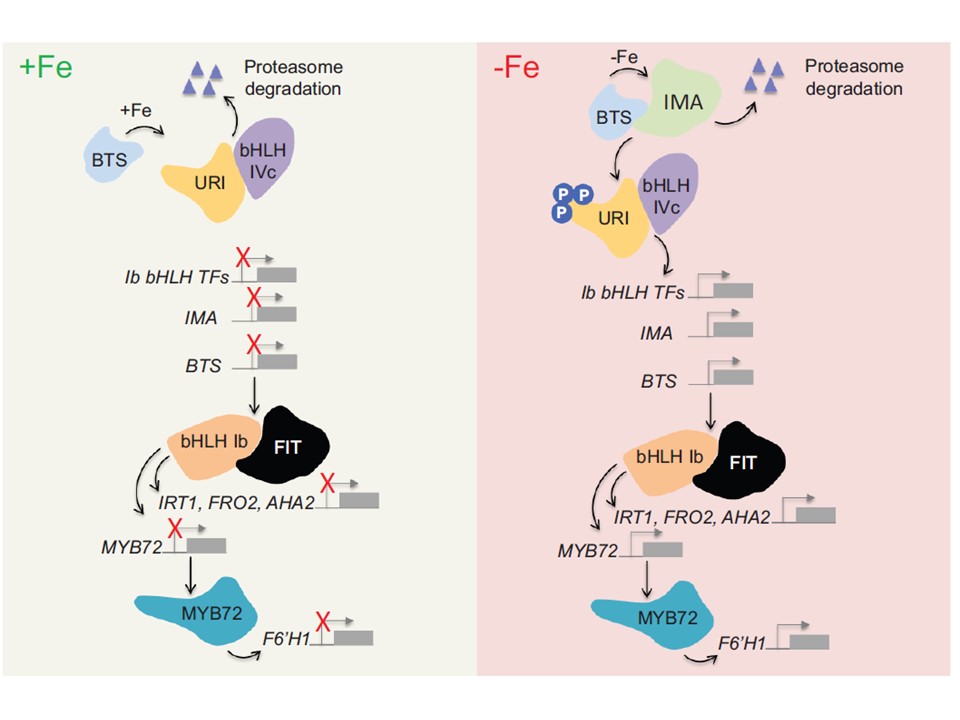
図1