(総説)植物鉄のホメオスタシスにおけるタンパク質リン酸化の新たな役割
この総説は、植物の鉄栄養に関する関連遺伝子の発現制御が、タンパクのリン酸化と脱リン酸化のよって行われている側面を整理したものである。鉄栄養制御研究の新しい展開である。
(要旨)ばかりでなく(結語と将来展望)も訳しておいた。
(総説)植物鉄のホメオスタシスにおけるタンパク質リン酸化の新たな役割
Emerging roles of protein phosphorylation in
plant iron homeostasis
Wenfeng Li,1 Xiuwen Han,1 and Ping Lan 2,3,*
Trends in Plant Science, Month 2022, Vol. xx, No. xx https://doi.org/10.1016/j.tplants.2022.03.012
(要約)
植物における鉄の恒常性維持に関わる分子機構は、トランスポーターや転写制御ネットワークの同定を中心に目覚しい発展を遂げてきた。
しかし、鉄の状態によって、これらのマスタープレイヤーのタンパク質活性がどのように制御されるかは、まだ十分に解明されていない。
最近の研究では、主要なプレイヤーは、異なる鉄条件下でタンパク質のリン酸化によってその性質を切り替え、その結果、シグナル伝達カスケードや代謝調節を制御していることが明らかになった。
さらに、鉄の欠乏は、複数のキナーゼやホスファターゼの変化を引き起こす。
これらの知見から、鉄の状態に応じて迅速かつ的確に反応し、鉄の恒常性を維持するためのタンパク質リン酸化依存的な制御機構が出現したことが明らかになった。
このような複雑なネットワークの制御を完全に理解するためには、さらなる研究が必要である。
(結語と将来展望)
植物は、鉄欠乏や鉄中毒を回避するために、転写やリン酸化などの多段階の制御を進化させてきた。
近年、タンパク質のリン酸化は、転写の変化とタンパク質の代謝回転を統合的に制御し、鉄のホメオスタシスを微調整する上位の制御機構であることが明らかになった。
これは、主要な輸送体IRT1や、FITやURIなどの制御カスケードに関与する中心的なTFの細胞内局在、タンパク質活性スイッチ、タンパク質安定性を操作することによって達成される。
しかし、このメカニズムは新しく登場したものであるため、まだ多くのギャップが残っている。
例えば、MxbHLH104はリン酸化によって制御されているが、他のIVc bHLHサブグループTFもリン酸化によって制御されているのだろうか?
URIとFITのチロシン部位でのリン酸化を調節するキナーゼは何か?
これらのキナーゼは鉄の状態によってどのように制御されるのか?
鉄応答性ホスファターゼの役割は何か?
StrategyIとStrategyIIを利用する植物の間の制御ネットワークの保存と適応の変化を考慮すると、StrrategyIIの植物におけるタンパク質リン酸化制御を調べることは価値がある。
タンパク質のリン酸化は、鉄の状態を感知し、シグナルを伝達し、その後、植物が生き残るための代謝調節を行うのに不可欠である。
この調節機構を解明することは、植物が十分な鉄分を維持し、欠乏や毒性を回避するための、多層的な相互作用の理解につながる。
この新しい知見は、植物の適応力を高めるための遺伝学的アプローチや、多くの国で見られる特定の微量栄養素の欠乏「隠れた飢餓」に取り組むための遺伝的アプローチの開発に役立つと考えられる。
(図1.の説明)
鉄の獲得制御に関与するリン酸化の模式図
IRT1は初期エンドソームに局在し、SNX1に依存してエンドソームと細胞膜の間を循環している。
CIPK23によるIRT1のリン酸化は、過剰な非鉄金属存在下でのIDF1のリクルートを促進する。
IDF1がIRT1のポリユビキチン化を促進する。
IRT1のポリユビキチン化は、IRT1のエンドソームへのソーティングとそれに続く液胞での分解を促進する。
SNX1はリン酸化を受けるかもしれない。
IRT1、FRO2、AHA2は、鉄の取り込み複合体を形成している。
IRT1が同じ残基でリン酸化されることで、取り込み複合体からの解離が促進される。
さらに、CIPK23はカルシウム依存的なシグナル伝達により、鉄欠乏条件下でのFCR活性を制御している。
また、アルカリ性 pH では、CIPK11 の発現が低下する。CIPK11 は AHA2 をリン酸化し、それによって AHA2 の活性を阻害する。
さらに重要なことは、図2に示されるように、CIPK11はFITをリン酸化し、その結果IRT1を誘発することである。
略号 AHA2, H+-ATPase 2; CIPK23, CBL-INTERACTING PROTEIN KINASE; Fe, Fe deficiency; FIT, FER; FRO2, FERRIC REDUCTION OXIDASE 2;IDF1、IRT1 DEGRADATION FACTOR1;IRT1、IRON-REGULATED TRANSPORTER1;pH、アルカリ性pH;SNX1、SORTING NEXIN1.
(図2. の説明)
タンパク質のリン酸化は、鉄のホメオスタシスを制御する中心的な制御因子の活性を調節する。
シロイヌナズナでは、鉄欠乏によりURIが未知のキナーゼによってリン酸化され、サブグループIVc bHLH TFsとの相互作用が可能になった。
その結果、URI は PYE の転写を促進し、FIT に依存しない応答とサブグループ Ib bHLH メンバ ーが FIT とヘテロ二量体を形成して FIT 依存の鉄吸収を促進する。
リン酸化された URI は、鉄の存在下で BTS によって分解される。
リンゴではbHLH IVcメンバーであるbHLH104もリン酸化されうるが、アラビドプシスでは明らかでない(破線の円で示す)。
一方、Feが欠乏するとCIPK11が誘導される。
CIPK11キナーゼによってSer272がリン酸化されると、FITが活性化され、
Ib bHLHメンバーとの相互作用が強化され、FIT依存的な鉄の取り込みが増加する。
間接的な証拠によれば、FITの活性は、代替的なTyrリン酸化によって阻害されることが間接的に示唆されている(破線矢印と破線円で示す)。
対応するキナーゼが同定されれば、この推測を強く支持することになる。
エチレン(ET)は鉄のホメオスタシスネットワークの重要なレギュレーターである。リン酸化はETの生合成とシグナル伝達に関与している。
ACS は ACC を ET に変換する。
MPK6 によって ACS6 がリン酸化されると、エチレン合成が増加する。一方、リン酸化酵素PP2AによるACS6の脱リン酸化はACS6を不安定にする。
鉄欠乏はACS6の発現を誘導し、MPK6を活性化し、鉄のホメオスタシス制御ネットワークに修復的(revisable)リン酸化を追加している。
プロテインキナーゼCTR1はEIN2のホスホリル化によりETシグナル伝達経路を阻害する。
EIN2はEIN3/EIL1を制御し、EIN3はFITと相互作用して安定化させる。EIN3はERF95依存的なFER1発現を通じて種子の鉄蓄積も媒介する。
略号 BTS, ブルータス; BTSL1, BTSlike1; CIPK11, CBL-相互作用タンパク質キナーゼ11; EIN3, エチレンINSENSITIVE 3;ERF95、ETHYLENE RESPONSE FACTOR95;Fe、Fe deficiency;FIT、FER-LIKE IRON DEFICIENCY-INDUCED TRANSCRIPTION FACTOR;PYE.POPEYE(ポパイ);ERF95、ETHYLENE RESPONSE FACTOR95;Fe、Fe deficiency。
popeye; uri, irt1 の上流制御因子。
(図3.の説明)
可逆的なタンパク質リン酸化は、光合成と逆行性シグナルによる鉄ホメオスタシスを制御している。
鉄欠乏条件下では、PSIIに結合している集光アンテナ(LHCB)タンパク質がPSIIから解離し、PSIに移行する。
この状態遷移には可逆的なリン酸化が関与している。LHCB のリン酸化と脱リン酸化は,シロイヌナズナでは STN7 と PPH1 のキナーゼ/ホスファターゼペアが仲介している.
また、PSII のコアタンパク質(core)は、STN8 キナーゼと PBCP ホスファターゼによって触媒されるリン酸化・脱リン酸化の変化を受けることができる。
しかし、これらのプロテインキナーゼやホスファターゼが、鉄の状態を制御した光合成の順応を制御しているかどうかは、まだ不明である(破線矢印で示す)。
SAL1は葉緑体に存在し、ホスホヌクレオチドPAPを脱リン酸化してAMPに変換する。
PAPは細胞内を移動し、細胞質タンパク質XRN4を阻害することで鉄のホメオスタシスを制御している可能性がある。
略号 PAP, 3′-phosphoadenosine 5′-phosphate; PBCP, PHOTOSYSTEM II PHOSPHATASE; PPH1, PROTEIN PHOSPHATASE1.
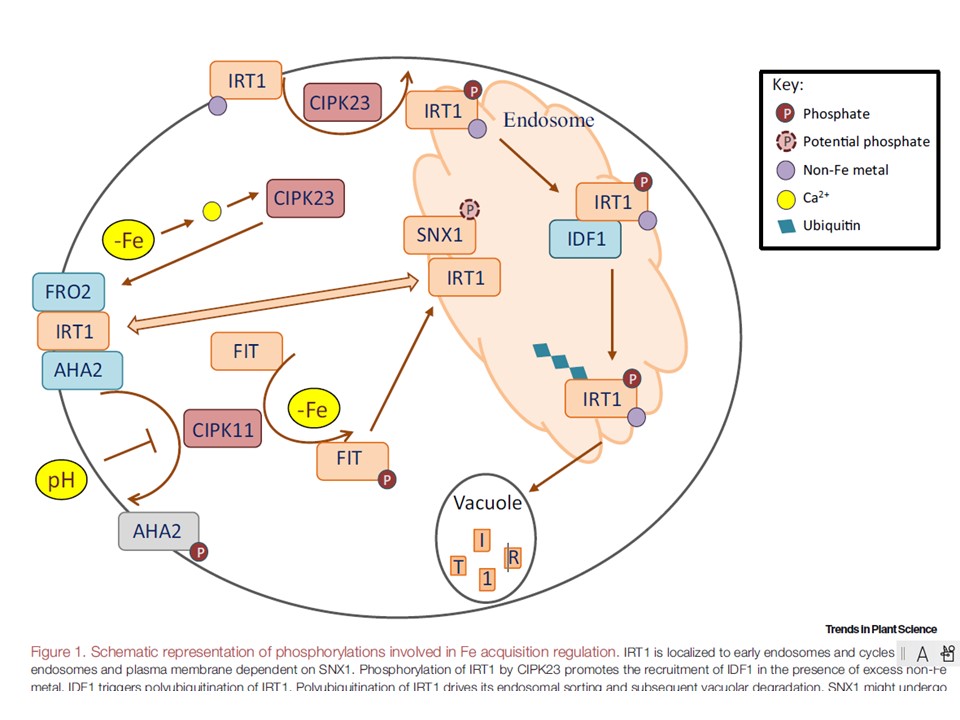
図1
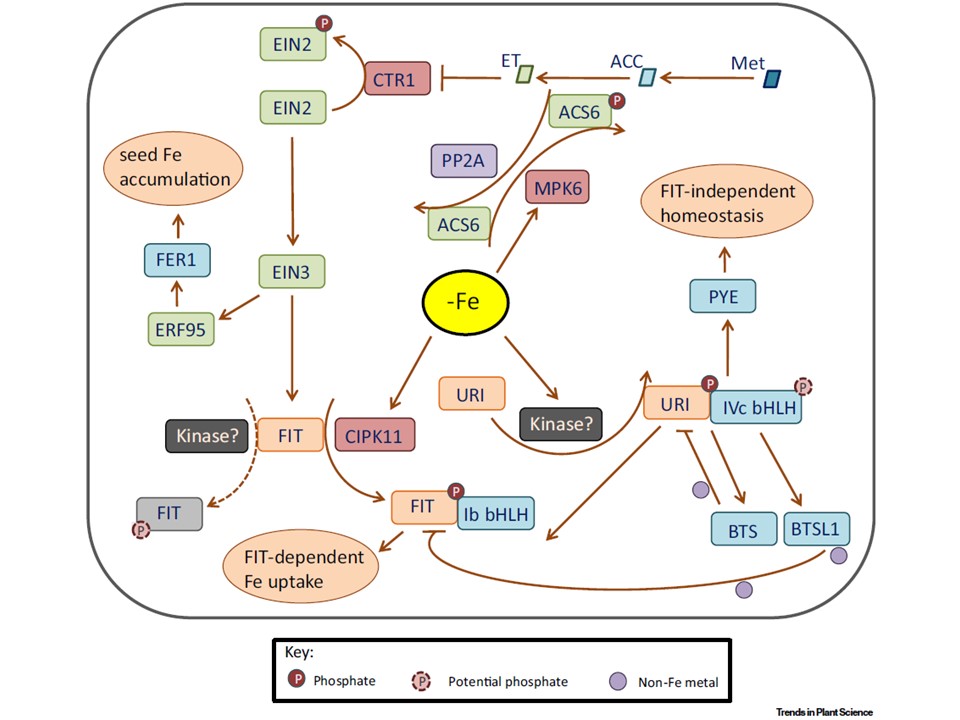
図2
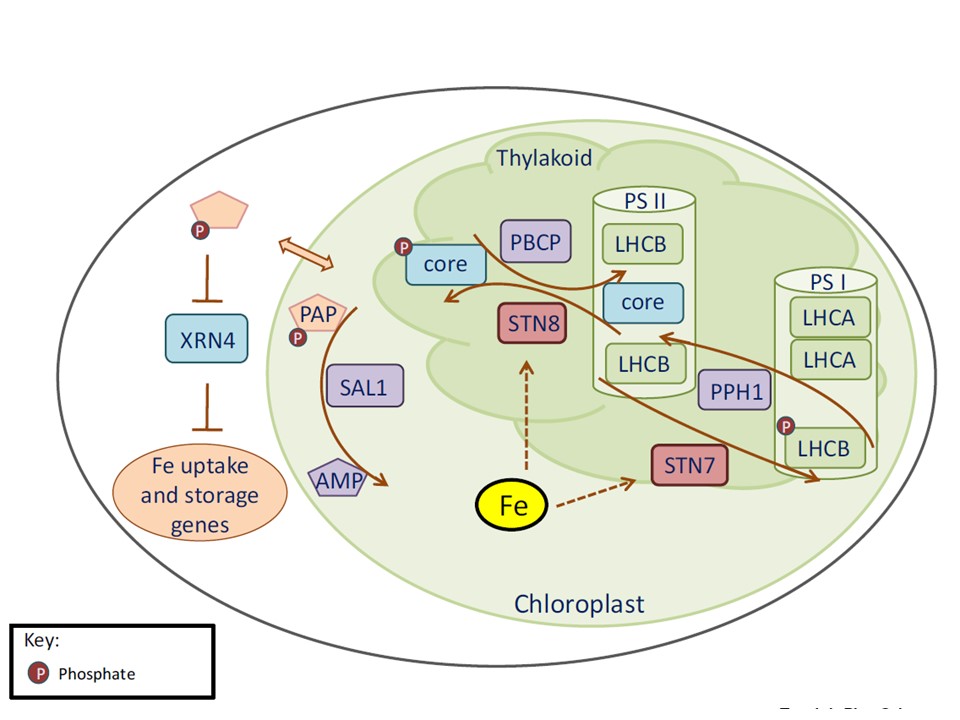
図3