(総説)植物の鉄ホメオスタシスの負と正の連携
以下の総説は非常に優れているので、全訳を試みたので少し時間がかかった。現下の植物の鉄栄養制御機構に関して、よくまとめている。植物栄養の教科書としても使える論考と思われる。日本の小林君(石川県立大教授)の論文が頻繁に引用されているのはうれしいことである。
植物の鉄ホメオスタシスの負と正の連携
Connecting the negatives and positives of plant iron
homeostasis
Gretchen E. Kroh and Marinus Pilon
New Phytologist (2019) 223: 1052–1055 _ 2019
この論説は Tissot et al.,New Phytologist 223: 1433–1446
に対するコメントである。
植物において鉄欠乏は多くの細胞の作用に影響を及ぼすが、特に鉄の要求が強い光合成を律速する。
土壌の鉄は利用性が貧弱な酸化鉄(III)として土壌に存在するので植物にとって鉄欠乏は普通に起こり得ることである。
同じく、フリーの細胞内鉄は障害的活性酸素種を生成するので鉄過剰も同じく植物の生育を律速する。
鉄欠乏条件下では植物は根からの鉄吸収を増大させ、貯蔵鉄から細胞内に鉄を遊離させて鉄要求性タンパクの使用に供する。
鉄レベルが高い時は根からの鉄吸収を低め、障害から避けるために過剰鉄を隔離する。
プラスチド内の鉄貯蔵分子であるフェリチンを制御することが、この両極端に応答する中心的な課題である。
低い鉄供給量ではフェリチンはダウンレギュレートされて鉄の隔離が低下し、一方で鉄過剰ではフェリチンはアップレギュレートされ酸化ストレスを阻止する。
鉄吸収と隔離は鉄の細胞内利用性に対して対立的効果となっているのでこれらの過程の制御は連携していなければならないのだが、今もってそのような関連は確立されていない(小林ら、2018)。
New Phytologistのこの号でTissot et al. (pp. 1433–1446)は、エレガントな遺伝子的手法で、鉄欠乏に応答して鉄吸収を正に制御(活性化)するbasic helix–loop–helix (bHLH) 転写因子として知られれているILR3/bHLH105について、それが同じくフェリチンmRNAの発現を負に制御する(阻害)作用を持つことによって、鉄ホメオスタシス応答を統合していることを示した(図1)。
「正と負の制御の結合によって体系的な鉄ホメオスタシスに好的な緊急対応の性質を提供出来ている」。
2つの戦略は土壌から鉄を得て、その吸収を増加させるために植物に進化したものである。
アラビドプシスを含む多くの植物はstrategy Iを利用して鉄によって制御されている根の細胞膜のTransporter 1 (IRT1)で吸収する。
鉄の利用性を増加するために、フェノール性化合物の分泌、根圏の酸化、Fe(III) から Fe(II)への還元は、転写レベルで大きく制御されているIRT1という一団(コホート)の細胞膜タンパクによって制御されている。(図2参照)
鉄欠乏下でのこのIRT1コホートの正の制御は、bHLH転写因子の連鎖(カスケード)を通じて行われている。
アラビドプシスの133個のbHLHメンバーのうちの16個が鉄ホメオスタシスの役割が明らかにされている。
この多数のbHLH転写因子群は、おそらく組織特異性と、仕事の区分を割り当てているのだろう。
すなわち、鉄の存在状態と植物成長制御因子などの一連の働きが統合されて一連の階層システムの中で鉄ホメオスタシスが制御されているのであろう。
IRT仲間の発現は、鉄欠乏誘導性プロモーターと結合する鉄欠乏誘導性bHLH タンパク FITと、サブファミリーであるIb bHLHとの二量体によって、転写制御(up-regurate)されている。
これらの下流のbHLHタンパクらは、より上流のサブファミリーであるILR3を含む bHLH タンパクによって、up-regurateされている。
上流のbHLH サブファミリーのメンバーの転写は低鉄濃度によって誘導がかかる。
これらのタンパクの類はBTS1(BRUTUS1) や BTSL (BRUTUS-like)と呼ばれるユビキチンライゲースを媒介とする代謝によって負に制御されている。これらのライゲースは「hemerythrin Fe-結合モチーフ」を有しているので鉄センサーの候補である。
このBTS1 と BTSLの転写も低鉄濃度で誘導される。
この仮の鉄結合ユビキチンライゲースを含む上流制御はStrategyII植物であるイネにも保存されており、ここではファイトシデロフォアが鉄吸収に関わっている(小林ら, 2018年)。
bHLH転写因子PYE (POPEYE)は、鉄の流動性の作用があるニコチアナミン合成酵素4 (NAS4)を含む遺伝子セットの負の制御因子として同定された。
PYEはILR3を含む上流bHLHタンパク群と二量体を形成することが分かっている。
Tissotらは今やILR3がPYEと組んで、3つのフェリチンファミリーメンバーとNAS4を含む遺伝子セットの負の転写制御を行うという証拠を提示している。
ILR3タンパクはそれ自体がBTS1 (あるいはおそらく BTSL)-経由の代謝回転の標的であるが,低鉄濃度ではそれはIRTコホート(補助的な分類上の階級の一つ)の正の制御として働き一方ではフェリチン類の発現を抑制している(図1)。
ilr3-1の対立遺伝子の gain-of-function実験では、鉄の水準の増加によりFER1の欠失が誘導され生育濃度表現系が現れた。
Ilr3-1は鉄のレベルを向上させ維管束組織構造の鉄を集積させた;これはフェリチン遺伝子の3重変異の表現型に似ていた。
確かに、このilr3-1ドミナント変異株でフェリチンを過剰発現すると生育の表現型が抑制された。
PYEは鉄レベルに応答性が高く、鉄欠乏で全身で発現する。
Tissot et al.らは以下の仮説を提唱している。
PYEはILR3を引きこんで複合体を形成するのだが、それは(鉄の)局在性を抑制するためであり、このことは、根や地上部でのあまりにも鉄の利用性が低くなることを避けるために重要なことである。
bHLH カスケードの最上流階層をFeセンシングユビキチンライゲースが負に制御することは、鉄吸収と鉄過剰のバランスをとるためのメカニズムである。
正と負の制御の組み合わせが、全身性鉄ホメオスタシスのための好都合な緊急対応性を提供している。
例えば、鉄欠乏誘導性IRT1タンパクは2価カチオンに対して無差別で、過剰のニ価金属が細胞質側のループに結合したときには代謝回転上では負に制御されて、過剰集積を阻止する助けとなる。
鉄ホメオスタシスの全身的制御にはほかに正と負の制御因子が関係している。
IRTコホートの制御には適切な地上部―根のコミュニケーションが必要であるのだが、これには葉の導管と師管の間の鉄の分布をモニターするためにOligo PeptideTransporter 3 (OPT3) や2種類のYellow Stripe Like ファミリータンパクであるYSL1 と YSL3などの膜タンパクが介在している。
OPT3と YSL1/3のそれぞれが全身性鉄吸収の負、と正、の制御因子であるかどうかは議論の余地がある。
OPT3は鉄欠乏で迅速に師管の伴細胞で、アップレギュレートされ、そこで鉄が導管から師管に移動するのを助けていると提案されている。
YSL1/3は「金属―NA複合体」を輸送し、通同組織に局在して、そこでおそらく師管からアポプラストへの輸送を仲介し、発達している葉や種子に鉄を利用可能にしている。
このモデルを支持することとして、「ysl1/ysl3 二重変異体」は葉脈間クロロシスを示し、葉や種子の鉄含有量が低くなる。
ysl1/ysl3変異体は全身的に鉄欠乏である。なぜなら、おそらくあまりにも過剰の鉄が師管に存在しているので、根のIRTコホートはアップレギュレートされないからである。
逆に師管での低い鉄レベルのopt3 変異体は構成的に過剰鉄状態であることを示している。
実際のところどのようにして師管は鉄の存在状態を根にシグナル伝達出来ているのだろうか?
過去に2つの研究のみが師管移動するFEP1 または IRON MAN (FEP/IMA)と呼ばれる、鉄欠乏で誘導される小さなペプチドが保存されていることが同定された。
FEP/IMAペプチドの過剰発現により、根のbHLH39 と Fe 還元酵素活性が活性化し、ロゼット葉の鉄含有量を増加させ、opt3 変異体と同様の表現コピー体を示した。
接ぎ木実験では地上部で生産されたFEP/IMAの役割について、根からの鉄吸収を正に制御するという強い証明がなされた。
現時点ではどのようにOPT3, YSL1/YSL3 , FEP/IMAが根の表皮細胞での鉄吸収に影響しているかは不明である。
OPT3 やLS1/YSL3については、膜輸送の方向性、動力学、特にOPT3に関してはその正確な基質がなんであるかなど、詳細な輸送のメカニズムは確立できていない。
FEP/IMAペプチドの中ではアスパラギン酸リッチなC-末端配列が高度に保存されており、この事が作用性に深く関係していることを示唆している。
この領域がFeを結合して鉄を隔離することによって、それ自身が
IRTコホートの負の制御因子であり得るのだろうか?
これらのペプチドは膜を通過しうるのだろうか?
その名が暗示しているようにOPT3のようなタンパクはFEP/IMAの膜輸送体であり得るのだろうか?
いくつかの根の鉄吸収を制御する同様のbHLH転写因子群は鉄欠乏で地上部でも誘導される。
FEP/IMA, OPT3, YSL1/YSL3などのプロモーターはすべてbHLH と結合しうるサイトであるG-box配列を有している。このことはこれらのペプチドが上層のbHLHタンパクに転写制御されているかもしれないことを示唆している。
bts1変異株ではOPT3は少なくとも根では非制御である。
OPT3 is misregulated in a bts1 mutant, at least in the root (Hindt et al., 2017).
したがってBST1は根や地上部での鉄欠乏応答性を制御しており、そのようにして局所的かつ長距離的シグナルのセンサーとして働いているのかもしれない(小林ら、2018)。
bHLH因子群の上層やBTS1ばかりでなくBSTLらそのものが、どのようにして低鉄濃度でアップレギュレートされているのかは、まだ解明されていない。
イネでの仮説の鉄結合転写因子(IDEF1/2)はアラビドプシスでは存在しないようだが、bHLH因子群やBrutusのホモログであるHRZ1/2よりも上流で働いているもかもしれない(小林ら、2018)。
ILR3は全身的鉄欠乏制御とシグナル伝達を統括することを助け得るのだろうか?
{PYE+ILR3}とそのほかの上層bHLH因子群が地上部の低鉄状況下で誘導されて、FERを抑制するのかもしれない。その結果葉の通導組織の鉄の再分配が容易になり、FEP/IMAを制御するのを助けるのかもしれない。
ILR3の抑制後のフェリチンの誘導は、もし植物が鉄欠乏後に鉄を再供給される場合は、適切な師管の鉄レベルを維持することを助けなければならない。
全身的鉄ホメオスタシスに関して前向きに理解を深めようとするならば、通導組織周辺のOPT3, YSL1/3 や FEP/IMAに関する分子レベルの作用や制御に関して、より深くメカニズムを考察しなければならない。
図1.ILR3は鉄(Fe)ホメオスタシスの負と正の制御因子として働く。
低い鉄栄養条件下では(左)、ILR3は強く誘導されたPYEとともに2量体としてフェリチン(FER)遺伝子発現を抑制する。そうして細胞内の大部分の利用可能性の鉄を、鉄を要するタンパクが利用できるようにする。
同時に、ILR3はほかのbHLH クラスのIVc タンパクとともに、土から根が鉄を吸収する メカニズムを正に制御する。
鉄要求性タンパクが十分鉄を利用できる鉄過剰条件下では、IRL3 と PYEは抑制され、過剰鉄を局在化するためにフェリチン遺伝子の発現増加が許される。
さらに、根からの鉄吸収活性は低くなる。
これによりフリーの鉄により活性化された、フェントン反応による活性酸素種(ROS)の発生を制御することを助けることになる。
図2.全身的鉄(Fe)ホメオスタシスの概観
根の鉄吸収の正の制御因子は緑色、負の制御因子は赤で示している。
細胞内フリーの鉄は吸収の負の制御因子である。
鉄欠乏に応答して植物は根の表皮細胞の鉄吸収機構(IRT集団)をアップレギュレートする。
IRT集団には4つの膜タンパクが含まれる:根圏を酸性化するAHA2、鉄結合クマリンを排出するPDR9、鉄を還元するFRO2,2価鉄を吸収するIRT1である。
根の吸収発現はFITがその下流のbHLH38/39タンパクと結合して制御されている。
bHLH34, bHLH104, bHLH115 , ILR3 (すべてがIVc bHLHタンパク分枝集団)の二量体は下流のbHLH38/39の発現を誘導する。
このカスケードはBTSLユビキチンライゲースによって負に制御されている。
鉄の利用性が低い場合は、上流のbHLHのタンパク群(bHLH34, bHLH104, bHLH115 and ILR3)もまたbHLH38/39 と bHLH100/101の発現誘導のために内鞘で発現している。これらの転写因子の直接的な標的は本文で広範に述べられている。
また、PYE と ILR3は結合して、局所的な鉄の貯蔵を低下させる過程をダウンレギュレートする。
転写レベルでのPYE/ILR3による負の制御の標的は、3種類のフェリチン(FER)、液胞への鉄付与を容易にする NAS4ニコチアナミン合成酵素、そのほか膜結合顆粒への局在を仲介するタンパク類である。
BTS1は内鞘での負の制御因子でもある。
葉ではOPT3は鉄を導管から師管に鉄を移行させる。
YSL1/3は恐らく鉄を師管から葉の柔組織のアポプラストに排出する。そこから鉄は大量の鉄を要求する光合成が活発な細胞に入りこむのだろう。
OPT3が根の鉄吸収の負の御因子であり、YSL1/3が鉄吸収作用の正の制御因子であるモデルは教科書的には矛盾がないが、これらの輸送体の作用のメカニズムは十分に解明されていないことに注意すべきである。
光合成は鉄によって強力に制約されているし、環境要因によって高度に制御されているので、クロロプラストの鉄関連タンパク(プロテオーム)は根の鉄吸収の正の制御因子たりうる。一方、ほかの細胞鉄タンパクはより構成的な作用を有している。
鉄欠乏時に師管の鉄レベルを調整するためにYSL1/3 と OPT3はそれぞれダウンレギュレーションとアップレギュレーションされている。
鉄欠乏下では師管中の単鎖ペプチド、FEP/IMA、の発現が増加する。これらは鉄吸収の正の制御因子である。
欠乏下では、第一義的に鉄はミトコンドリアの作用に優先利用される。そして、プラスチドでは光合成タンパクと、その他のクロロプラストが要求する鉄要求性タンパクのために利用可能な鉄を増加させるために、FERの発現はダウンレギュレートされる
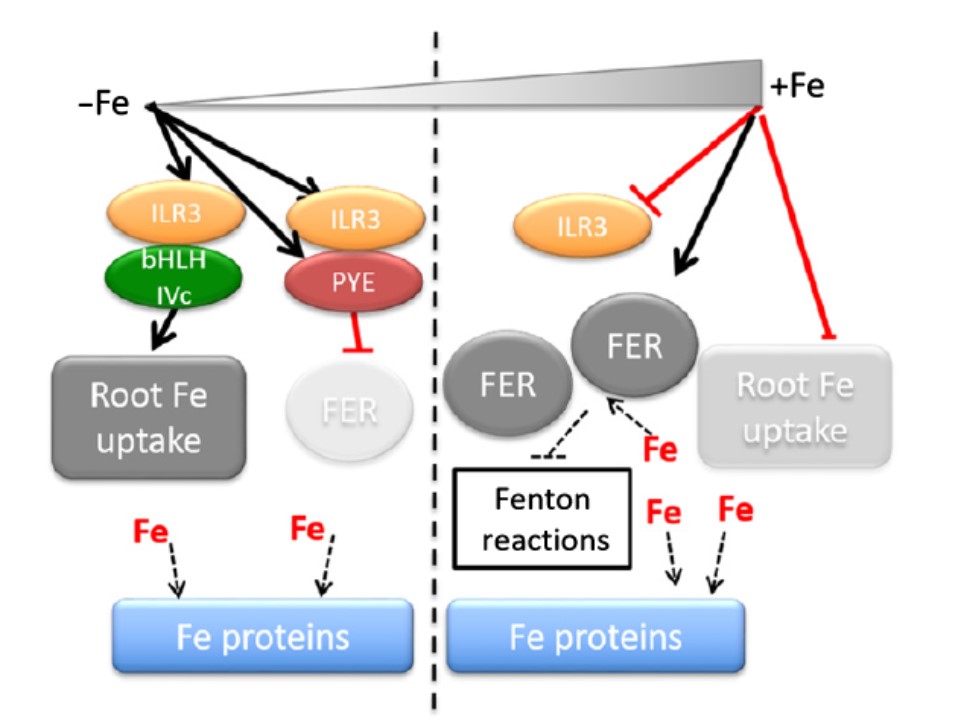
図1
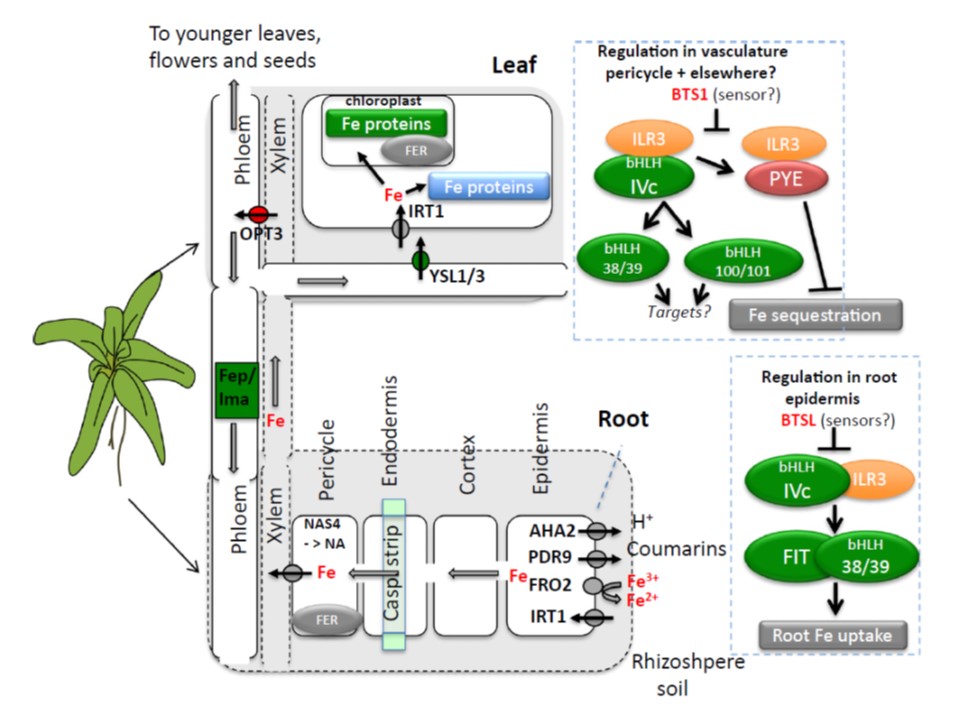
図2