必須であるが有毒でもある―鉄の細胞内輸送と鉄ホメオスタシス
必須であるが有毒でもある―鉄の細胞内輸送と鉄ホメオスタシス
Essential and Detrimental — an Update on Intracellular Iron Trafficking and Homeostasis
Gianpiero Vigani, A´da´m Solti, Se´bastien Thomine and Katrin Philippar
Plant Cell Physiol. 60(7): 1420–1439 (2019) available online at https://academic.oup.com/pcp
(要旨)
クロロプラスト、ミトコンドリア、液胞は細胞内の代表的な顆粒であり、細胞代謝で支配的な働きをしている。
クロロプラストは光合成の部署であり、植物の光独立栄養的な成長に基本的かつ本質的である。
ミトコンドリアは呼吸によりエネルギーを生産し、液胞は細胞内廃棄物処理場であり、かつ貯蔵庫でもある。
さらに、クロロプラストとミトコンドリアは様々な一次代謝産物や二次代謝産物の生合成の部署でもある。
光合成やエネルギー生産のためにクロロプラストやミトコンドリアの内膜には電子伝達鎖が備えられている。
適切な電子伝達やいくつかの生合成機能を完遂するために、この二つの顆粒は遷移金属元素を含有しているのだが、中でも鉄が圧倒的に豊富含まれている。
であるから鉄は植物の生長と発達にとって必須であるのだが、過剰にあるいはフリーの形で存在すると有害となる。
後者の場合の有害な効果は酸化ストレスを生成することによって引き起こされる。
それ故に、鉄の輸送とホメオスタシスは植物の成長と発達の過程で緊密にコントロールされていなければならない。
これらの鉄の輸送とホメオスタシスに対応したタンパクの類にくわうるに、液胞は、植物のある発達時期の鉄の細胞内貯蔵と放出のコンパートメントとして重要な働きをしている。
この総説ではクロロプラスト、ミトコンドリア、液胞における鉄の輸送とホメオスタシスに関する最新の知見を取りまとめる。
さらに、細胞内鉄ホメオスタシスが細胞プロセスと植物の発達プロセスに与える、生理学的インパクトについても総括を試みた。
図1.クロロプラストでの鉄輸送と鉄ホメオスタシス
クロロプラストの外膜(OE)を介する鉄吸収はFeIII−キレートの形で行われていると提案されている。
おそらくFeIII−クエン酸が未知のß-barrelOEP(外膜タンパク)を経由する。
クロロプラストの内膜(IE)ではFCR FRO7が膜内空間(IMS)でFeIII-キレートを還元する。
そのご、内膜タンパクであるNiCoとFe2+が結合しパーミエース(PIC1)による吸収が始まるのだろう。
この輸送は部分的には、少なくともIE(灰色の△)を介したプロトン勾配に依存している。
コロロプラストのストロマでは、鉄はFe–Sクラスターとヘムの生合成に供給される。そればかりでなく、多数の、クロロプラストに固有の代謝経路に関係する鉄を要求する酵素類(FeRE)にも鉄が供給される。
NEETタンパクと単子葉に固有のFDR4は鉄のFe–S クラスター機構への移行とチラコイド(THY)膜の横断に関係しているとこれまでの研究では述べられてきたが、鉄吸収後の(ストロマ内での)鉄の譲渡(移行)に関しては何もわかっていない。
また、ストロマに局在して鉄の輸送体類と相互作用するパートナーに関してはこれまで誰からも述べられていない。
成熟したクロロプラストでの鉄の過剰集積下や種子のプラスチドでの鉄の蓄積のためには、フェリチンタンパク(FER)の殻が鉄過剰ストレスを防ぐための緩衝剤として作用している。
さらに、鉄結合タンパクであるフラタキシン(FH)も、これは主にミトコンドリアのマトリックスの中に見出されるものであるが(第2図参照)、プラスチドでの鉄貯蔵に貢献しているかもしれない。
鉄吸収に関しては、IREG3/MAR1ばかりでなくミトコンドリアのキャリアーファミリー(MCF)Mfl1タンパクの役割に関してもこれまで述べられており、これがPIC1への代替経路をでありうるかもしれない。
しかし、MCファミリ―に属するキャリアータンパクの一般的な輸送反応はアンチポート機構によるものとされているので(トランスポーター分類データベ−ス TCDB at http://www.tcdb.org 参照)、Mfl1による二価鉄輸送に対するカウンターイオンは未知である。
IREG3/MAR1経由で輸送される鉄はニコチアナミン(NA)でキレート化されており、このフェロポーチンファミリーがプロトンアンチポート機構を必要とするかどうかは不明である。
Fe-NAの排出はおそらく主にオリゴペプチドファミリートランスポーターYSL4 と YSL6経由で行われているだろう。しかしこれもオリゴペプチドトランスポーターファミリーで言われているように、プロトン共輸送によるものであろう。
潜在的なPIC1/NiCo複合タンパクによる鉄輸送は、成熟した光合成活性が活発なクロロプラストの主要な経路であろうと思われる。
Fe-NA化合物がIREG3/MAR1やYSL4, YSL6を経由して輸送されることは、種子形成時や葉のセネッセンスの時、あるいは鉄過剰時でのYSL6による鉄排出に最も重要である。
原核生物タイプのNBD-サブユニットをコードする, マルチサブユニット ABC トランスポーター複合体であるABCI11/NAP14遺伝子はクロロプラストの鉄ホメオスタシスに関与している。
これまでのところ、相互作用するパートナータンパクは見つかっていないし、ABCI11/NAP14がIEまたはプラストグロビユール(PG)と関係するか、両者とも関係するかは未知である。
ただつい最近になって、IEに固有のABCI12とABCI10/NAP13の可溶性NBD-サブユニットが、新規の原核生物タイプの金属輸送ECF ABC-トランスポーター複合体の一部で、おそらくはクロロプラストでの吸収に関係していると述べられている。
ここではABCI10はATP結合サブユニットCbiO/EcfAを代表しており、一方ではABCI12は膜特異的なエネルギーカップリングサブユニットCbiQ/EcfTに似ている。
PIC1以外のIEに繰り込まれている他の鉄輸送タンパク類はこの図には明確には示していないことに注意していただきたい。
すべての膜タンパクについて予想されるアルファヘリックス膜貫通ドメインの数(a-TMD, Aramemnon database)とTCBD(Saier et al. 2006)による命名ファミリーは以下のとおりである:
ABCI12 (5 a-TMD, ABCI-subfamily ABC transporter, TC 3.A.1); FDR4 (2–4 a-TMD, specific for monocots); FRO7 (11 a-TMD); IREG3/ MAR1 (11 a-TMD, ferroportin family, TC 2.A.100); Mfl1 (6 a-TMD, mitochondrial carrier family, TC 2.A.29, MFL-type); NiCo (6 a-TMD, Ni2+/ Co2+ transporter family, TC 2.A.52); PIC1 (4 a-TMD, TC 2.A._PIC-type carrier); YSL4, YSL6 (14 a-TMD, oligopeptide transporter family, TC 2.A.67_YSL-type).
図2.ミトコンドリアでの鉄輸送と鉄ホメオスタシス
イオンや代謝産物のミトコンドリア外膜(OM)の横断は一般的なß-barrelポリンVDAC経由だと考えられている。
強固に入り組んだ内膜(IM)の鉄輸送はFe2+の形で起こっていると想定されている。
であるからミトコンドリアのOM とIMの鉄輸送のメカニズムはクロロプラストの膜の通路と似ていると考えられる。(図1参照)
鉄の還元には鉄キレート還元酵素FRO3 とFRO8がミトコンドリア内での作用に関係するとされてきた。
しかしFRO3 またはFRO8がOMにあるのか IMにあるのかはいまだに不明である。だからFeIII-キレートがミトコンドリアのFRO酵素の基質として存在する場所がミトコンドリアの細胞質なのか膜内空間(IMS)なのかは不明である。
Fe2+の吸収にはミトコンドリアのキャリアーファミリー(MCF)に属するMITタンパクが選抜候補である。
しかし、通常MCファミリーのキャリアータンパクはアンチポート機構(TCDB at http://www.tcdb.org 参照)による輸送反応であるのだが、MITによるFe2+輸送のカウンターイオンはいまだにわかっていない。
かてて加えて、Fe/Zn CDF(カチオン拡散促進因子)に属するMTP6 とMTP7タンパクはIMを横断する鉄のシャトル(繰り返し運転バス)だといわれている。
プロトン(H+)と交換してMTP6は鉄過剰集積時にFe2+をミトコンドリアのマトリックスの外にたぶん排出するのだろう。
しかし細胞質での鉄過剰集積の際にはMTP7が鉄をミトコンドリアのフェリチン(FER)に与えて貯蔵しROSストレス(compare Fig. 1 の FER参照)を防ぐと信じられている。
ミトコンドリアマトリックスでの正常な鉄供給時にはフラタキシン(FH)がFe–Sクラスターの形成とヘムの生合成のために鉄を供給する。
さらに、集合した鉄要求性のタンパク(FeR)は本文に述べているように多数の代謝機能に関係している。
呼吸鎖による電子伝達はIMを介して強いプロトン勾配(灰色の△)を形成し、ここで最も際立った経路を発揮する。
細胞質Fe–Sクラスター集合とモリブデンコファクター(MoCo)合成もミトコンドリアによって供給される。それはIM-在中 ABC トランスポーター ATM3によって排出されるglutathione polysulfide (GSSSG)によるものである。
すべての膜タンパク類、膜貫通ドメインのアルファヘリックス構造(α-TMD, Aramemnon database)の想定数と、ファミリーの名称はTCBD (Saier etal. 2006)によるものであり、以下のとおりである;
ATM3 (2_ 6 a-TMD-NBD, ABCB subfamily ABC transporter, TC 3.A.1_ATM-type); FRO3, FRO8 (11 a-TMD); MIT (6 a-TMD, mitochondrial carrier family, TC 2.A.29_MIT-type); MTP6, MTP7 (6 a-TMD, other cation carrier group-CDF family, TC 2.A.4_Fe/Zn CDF-type).
図3 アラビドプシス種子の液胞での鉄の貯蔵と再可動
(左)種子の胚芽の発達段階ではトランスポーターVIT1が
鉄(赤丸)を貯蔵のために子葉と根の内胚/perivascular細胞(赤色)の液胞(ピンク色)に送り込む。
VIT1はおそらくFe2+をプロトン(H+)をアンチポーターとして液胞膜(トノプラスト)のプロトン勾配を使って輸送する。
この貯蔵液胞では鉄はフィチン顆粒(phytate globoids:濃い灰色)に集合し、3価鉄フィチン体として貯蔵される。
(右)種子発芽と初期の実生の発達段階では、液胞の鉄はNRAMP3, NRAMP4のプロトン共輸送によって再可動され、鉄は優先的にクロロプラストに供給され、チラコイド(THY)膜での光合成電子伝達に使われる。
鉄含有光合成システムII (PSII)ばかりでなく、チトクロームb6f複合体、フェレドキシン(Fd)など、ここでは3つのFe4–S4クラスターを持つPSIが最も豊富な鉄機構の代表である。
しかしながらこれらの発達過程のクロロプラストへの鉄の取り込み過程についてはいまだに不明である。
アラビドプシスのVIT1 ,NRAMP3, NRAMP4に関して予想されるアルファヘリックス膜貫通ドメインの数 (a-TMD, Aramemnon database) (Schwacke et al. 2003)、またTCBD(Saier et al. 2006)によるファミリーの名称は以下のとおりである;VIT1 (5 a-TMD, other carrier groups-
VIT family, TC 2.A.89_VIT-type); NRAMP3, NRMAP4 (12 a-TMD, other carrier groups-NRAMP family, TC 2.A.55_NRAMP-type).
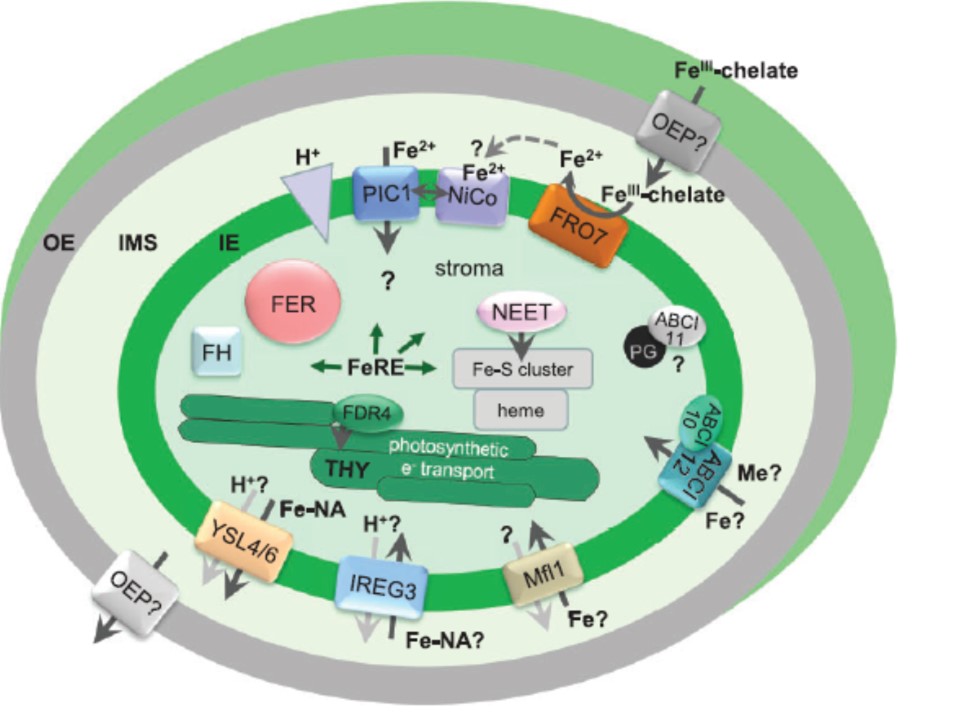
図1.クロロプラストでの鉄の動態
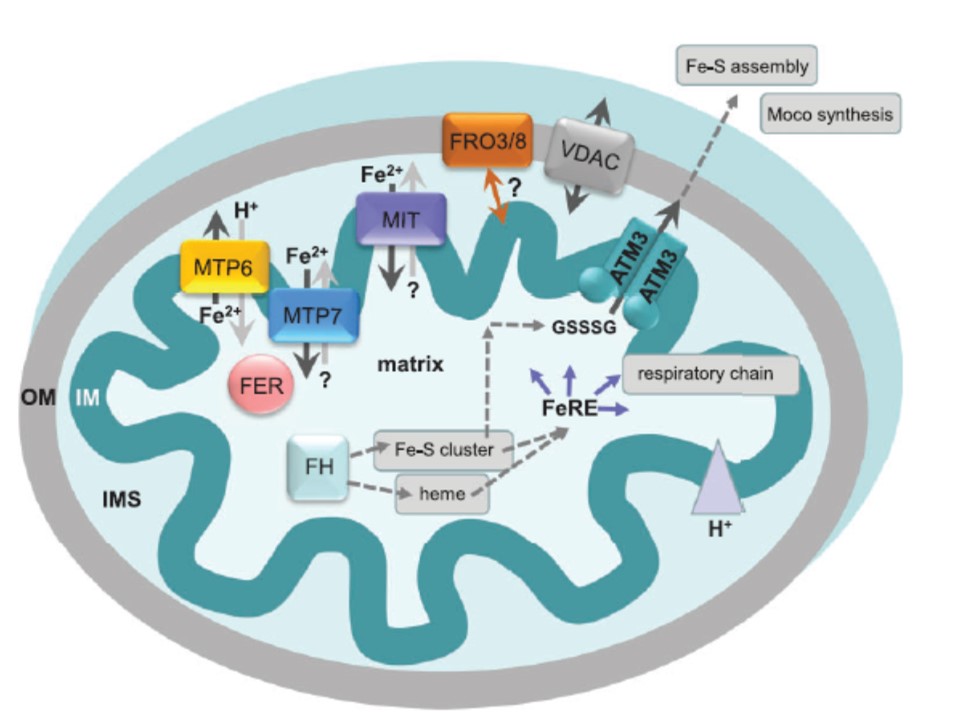
図2.ミトコンドリアでの鉄の動態
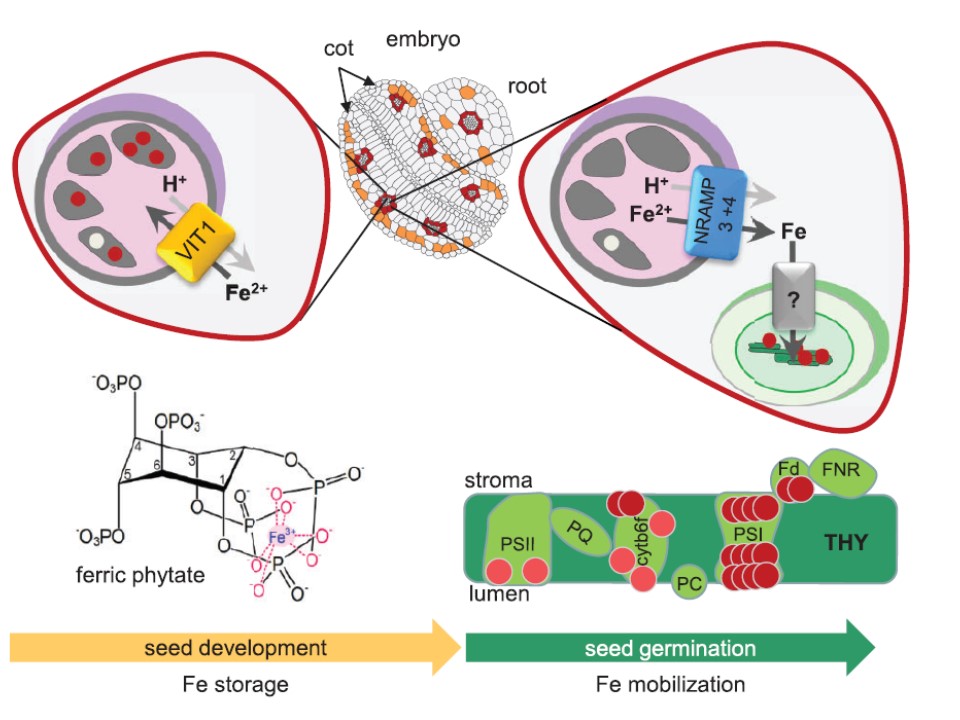
図3.種子での鉄の動態