鉄結合E3ライゲースはbHLH転写因子をターゲットにして植物内の鉄に応答する
鉄結合E3ライゲースはbHLH転写因子をターゲットにして植物内の鉄に応答する
Iron-Binding E3 Ligase Mediates Iron Response in
Plants by Targeting Basic Helix-Loop-Helix
Transcription Factors
Devarshi Selote, Rozalynne Samira, Anna Matthiadis, Jeffrey W. Gillikin, and Terri A. Long
Plant Physiology_, January 2015, Vol. 167, pp. 273–286
(要旨)
植物や動物において鉄の吸収と代謝は緊密に制御されている。
アラビドプシスではBRUTUS(BTS)は3つのhemerythrin (HHE) ドメインとReally Interesting New Gene (RING) ドメインを有しており、basic helix-loop-helix(bHLH)転写因子と相互作用する鉄欠乏応答性の正の制御因子である POPEYE (PYE)とヘテロダイマーを形成する。BTSはE3リガーゼ能を有しており、鉄欠乏に対する根の成長、根圏の酸性化、鉄還元活性にたいする役割を演じていることがわかっている。このタンパクの作用をさらに明らかにするためにProBTS::b-GLUCURONIDASE組み替え体を作成して、BTSが生殖期の成長や発生と見かけ上連動して、発生中の胚芽やほかの生殖組織で、発現していることを見出した。
また、BTSとPYE-like (PYEL)なbHLH転写因子は核内で相互作用していて、それがBTSのRINGドメインに依存していると考えられた。
また、BTSが鉄欠乏条件下でPYELタンパクが26プロテアゾーム経由で分解されることを促進するという証拠を示した。
また、鉄がBTSのHHEドメインと結合すると不安定化するが、その不安定化はHHEドメイン内の特異的なアミノ酸残基に依存することも明らかにした。
本研究は、鉄欠乏応答に関する遺伝子発現制御ネットワークの構成成分をE3ユビキチンリガーゼで翻訳後制御するという植物鉄ホメオスタシスに関して重要でユニークなメカニズムを明らかにしたものである。
(まえがき)
鉄は多くの代謝過程に関係している本質的な成分なので生物にとって鉄欠乏は重要な問題である。同様に鉄過剰も鉄が酸素と結びついて障害的な活性酸素種を生成するので問題である。だから植物や動物は鉄の体内利用に対する応答を厳密に制御している。
植物は土壌から鉄を吸収するために2種類の基本的な方法を進化的に獲得した。
低鉄栄養条件下ではイネやトウモロコシなどの単子葉(grass)植物はまずStrategy-IIの応答をする。そこでは根圏に
phytosiderophore (ファイトシデロフォア)を分泌しこれがFe3+と高親和的に結合する。この鉄・キレートは細胞膜に局在するyellow stripe やyellow stripe -like(YSL)輸送体を経由して根に取り込まれる(Curie et al., 2001; Inoue et al., 2009)。 また、いくつかの研究ではイネはまた直接Fe2+を直接取り込むことができる。
双子葉植物とnongraminaceous単子葉植物は低鉄栄養条件下ではStrategy-Iの方式を利用する。アラビドプシス(Arabidopsis thaliana)はStrategy-Iの応答を示し水素イオンを通すH+ATPase, よく知られたAHA2の遺伝子発現と酵素活性を増加させて、根圏を酸性化して根端細胞付近の酸化鉄を可溶化する(Römheld et al., 1984; Santi and Schmidt,2009)。また同時に膜結合鉄還元酵素FERRIC
REDUCTASE OXIDASE2 (FRO2)活性を高めてFe3+をFe2+に還元する(Robinson et al., 1999)。Fe2+は細胞膜に局在するIRONREGULATED TRANSPORTER1 (IRT1)によって表皮細胞に取り込まれる。このIRT1は細胞膜に局在しておりFe, Zn, Mn, Cdなどの金属イオンも輸送する(Eide et al., 1996; Vert et al., 2002; Colangelo and Guerinot, 2004)。
鉄は吸収されたのちニコチアナミンやクエン酸などのキレートと結合して通導組織に入る。
この連動した鉄欠乏応答はbasic helix-loop-helix (bHLH) 転写因子であるFER-LIKE FE DEFICIENCYINDUCED TRANSCRIPTION FACTOR (FIT; Colangelo and Guerinot, 2004)によって制御されている。
FITは他の2つのbHLHタンパク(Yuan et al., 2008) ETHYLENE
INSENSITIVE3 and ETHYLENE INSENSITIVE3-LIKE1
(Lingam et al., 2011)と協奏しておりNOの存在下で26プロテアゾーム依存性分解という翻訳後の制御を受ける。このFITに依存しない鉄のホメオスタシスの経路がありそれにはbHLH100とbHLH101 (Sivitz et al., 2012)が関与していることが同定された。
近年Strategy-II植物の応答に似た鉄結合性キレート化合物としてフェノール化合物やリボフラビン化合物がアラビドプシスやMedicago truncatulaから分泌されていることが明らかにされてきた。フェニルプロパノイドやフラビン合成の代謝経路は鉄獲得機構構成のコア遺伝子であるFIT, FRO2, IRT1, and AHA2, に強くリンクしている。なのでこれらはアラビドプシスやM. truncatulaのStrategy-Iの構成分とも考えられる。
我々はbHLHタンパクであるPOPEYE (PYE)がアラビドプシスの鉄欠乏応答反応をポジテイブに制御してホメオスタシスを維持している重要な役割を果たしていることを報告した。PYEはいくつかの近縁ホモログであるIAA-LEUCINE RESISTANT3 (ILR3), bHLH104, bHLH115, などと相互作用する。以後これらをPYELタンパクと称する。
これらのPYELsは鉄欠乏でupレギュレイトされており(Long et al., 2010)、そのうちの一つであるILR3はよく知らえているようなオーキシンと共役した加水分解を鉄依存的なやり方で制御している。おそらくは鉄トランスポーター類が遺伝子発現を転写制御するやりかたで(Rampey et al., 2006)。
PYEと異なり、あとの3つのPYELタンパクは第2のタンパクであるBRUTUS (BTS)と相互作用している。BTSは低濃度の鉄に応答して誘導されており、BTSの誘導を欠失させると鉄欠乏耐性が増加し、wild-typeの植物に比べて根の伸長や、根圏酸性化が増す(Long et al., 2010)。
BTSはユニークないくつかの保存ドメインを持っている。N末端側に3個のhemerythrin (HHE) カチオン結合ドメインを持ち、C末端側にはCHY zinc-finger ドメインとReally Interesting New Gene (RING)ドメインを持っている。
保存されたHHEドメインにはleft-twisted 4-a-helical bundlesがあり、ここは疎水性ポケットを形成しており、そこでO2が2個の鉄と配位結合している。
鉄はHHEドメインの中でGluとAspのカルボキシル基と5つのHis残基と典型的な結合をしている。しかし他の配位結合の仕方も提案されている(Holmes et al., 1991; Holmes and Stenkamp, 1991; Shu et al., 2012)。 BTSタンパクのC末端近傍のRINGドメインの存在は、そこがE3 ligaseの能力を有するかもしれないことを示唆している。
イネのBTSとBTSオルソログはOryza sativa Hemerythrin motif-containing RING and Zinc-Finger Protein1 (OsHRZ1)とOsHRZ2であるが鉄をHHEドメインで結合し、ユビキチン化能を有している(Kobayashi et al., 2013)。しかしBTSが相互作用する鉄応答性のPYELタンパクがE3リガーゼ活性のターゲットであるかどうかは調べられていない。
そこで我々はBTSはPYEL転写因子を標的にしてRINGドメイン(E3 ligase)を通じての26S proteasome-経由の分解に関与する鉄ホメオスタシスのネガテイブレギュレーター(負の調節因子)であろうという仮説を立てた。
このE3リガーゼ活性はBTSの安定性の変化に依存しており、その安定性はHHEドメインに影響され、したがって鉄
の利用性の揺らぎ(変動)に応答している。
我々はBTSの発現を植物の発達段階を通して様々な組織で探索し、鉄欠乏応答と生殖成長におけるBTS発現の変動の意味についても分析した。
同時に我々はBTSのHHEドメインを介した鉄結合能を調べた。鉄が濃度依存的にBTSの安定性に影響し、HHEドメインの特異的アミノ酸残基がこの蛋白の安定性に決定的であることを証明した。
我々はさらにBTSタンパクとPYELタンパクの相互作用がRINGドメインに依存する事、またBTSが少なくとも2つのPYELタンパクが26S proteasomeを経由する分解を助けることを見出した。
結論として我々の実験結果によって、BTSが、特にbHLH転写因子を制御することによって、植物における鉄ホメオスタシスの維持に重要な役割を有することが明らかになった。
以下図の説明
BTSタンパクの安定性とその作用モデル
A. BTSタンパクは、bHLH型の転写因子であるPYEとPYELと連動して鉄欠乏で転写誘導される。低濃度の鉄栄養条件下ではBTSタンパクはより安定でありPYEL/PYEの制御活性をE3ライゲース活性で制御している。つまりPYEL/PYE経由の植物の鉄欠乏応答を調整したり微調整したりしている。
B. 鉄が供与されると、BTS、PYE、PYELの転写レベルでの誘導が低下する。鉄濃度の上昇がHHEドメインで検知されるとBTSタンパクの形状と安定性が変化する。その応答の結果BTSタンパクの分解が起こり、その後の細胞の鉄応答性E3ライゲース活性が低下する。
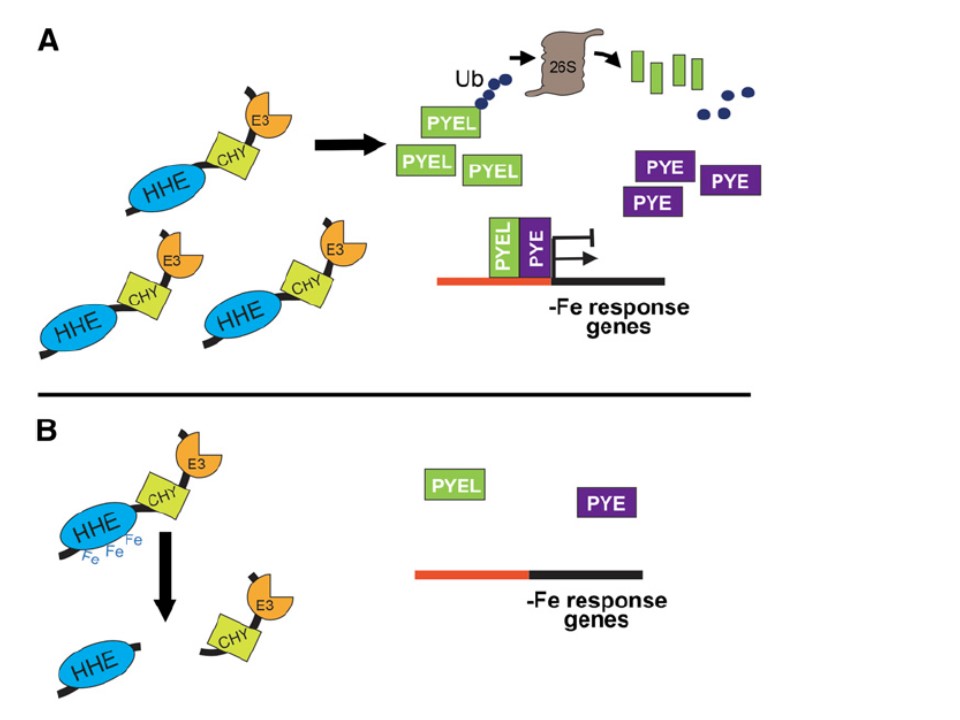
BTSの作用モデル